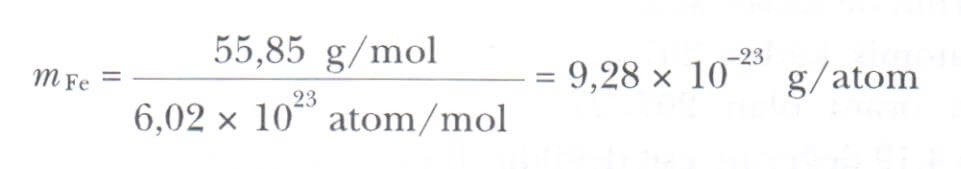Herhangi bir maddenin özelliği olan yoğunluk p(rho) birim hacimde bulunan madde miktarı olarak tanımlanır ve aşağıdaki gibi ifade edilir.
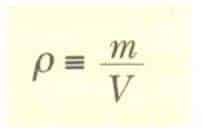
Örneğin, alüminyumun yoğunluğu 2,70 g/cm3, kurşunun yoğunluğu 11,3 g/cm3 dür. Yani, 10 cm3 hacmindeki bir parça alüminyum 27,0 g’lık kütleye sahiptir. Aynı hacme sahip kurşun ise 113 g lık kütleye sahiptir. Tablo 1.5’de farklı maddelerin yoğunlukları listelenmiştir.

Alüminyum ile kurşunun yoğunlukları arasındaki fark, kısmen atomik kütlelerinin farklı olmasındandır. Bir elementin atomik kütlesi, tüm izotopları dahil olmak üzere bu element numunesindeki bir atomun ortalama kütlesidir.Burada izotopların bağıl miktarı, doğadaki bağıl miktarı ile aynıdır. Atomik kütlenin birimi de atomik kütle birimi (u)’dir. 1u = 1,660 540 2 x 10^27 kg’dır. Kurşunun atomik kütlesi 207 u, Alüminyumun ki 27 u dir. Bunların atomik kütlelerinin oranı olan 207/27 = 7,67 değeri, yoğunluklar oranı olan 11,3/2,70 = 4,19 değerine eşit değildir. Bu uyuşmazlığın nedeni, bu maddelerin kristal yapılarındaki atomik mesafe ve diziliş farklılığıdır.
Bir çekirdeğin kütlesi, çoğu kez C^12 şeklinde yazılan karbon-12 izotopu’nun kütlesine göre ölçülür. (Bu karbon izotopun’da 6 proton, 6 nötron vardır Diğer karbon izotopları, 6 protona fakat farklı sayıda nötrona sahiptir.) Pratik olarak, bir atomun bütün kütlesi çekirdek içinde toplanır. C’nin atomik kütlesi tam olarak 12 u olarak tanımlandığından, proton ve nötronların her biri yaklaşık 1 u kütleye sahiptir.
Bir maddenin bir molü, 12 gram karbon-12 izotopun’da bulunan atomlardaki bir çok parçacığın (atomlar, moleküller ve diğer parçacıklar) madde miktarı kadar madde içerir. Bir A maddesinin bir molünde, 1 mol’lük başka bir В maddesinin içerdiği parçacık sayısı kadar parçacık bulunur. Örneğin; 1 mol alüminyumda, 1 mol kurşunda bulunan atom sayısı kadar atom bulunur. Deneyler, Avogadro sayısı olarak bilinen bu sayının değerini Na = 6,022137 x 10^23 parçacık/mol olarak verir.
Avogadro sayısı, 1 mol karbon-12 atomunun kütlesi tam olarak 12g alınarak tanımlanır. Genel olarak, herhangi bir elementin 1 mol’ünün kütlesi, o elementin atomik kütlesinin gram olarak ifadesidir. Örneğin 1 mol demirin (Atomik kütle = 55,85u) kütlesi 55,85g’dır (buna molar kütlesi 55,85 g/mol deriz) aynı şekilde 1 mol kurşunun (atomik kütle = 207 u) kütlesi 207 g (molar kütlesi 207g/mol)’dır. Herhangi bir elementin 1 mol ‘ünde 6,02 х 10^23 parçacık bulunduğundan, verilen bir elementin atom başına kütlesi aşağıdaki gibi olur.

Örneğin, demir atomunun kütlesi aşağıdaki gibidir.