Bir kimyasal tepkimeyi geliştirmek, incelemek ve iyileştirmek için, olaya katılan, genellikle karmaşık molekülsel süreçleri ayrıntılı şekilde bilmek şart değildir. Üretilen veya tüketilen ısının ölçümü, genelde yeterli olur. Termokimyanın konusuna giren bu ölçüm, pek çok tepkimeyi etkinleştirmiş, hatta birçok tepkimenin esin kaynağı olmuştur. Termokimya, her kimyasal sisteme özgü enerji içeriği olan «entalpi» ile ilgilenir. Bazı tepkimelerin, mesela benzinin yanma tepkimesinin bir özelliği de, tepkin maddelerin enerji içeriklerinin, ürünlerin enerji içeriklerinden fazla olmasıdır.
Bu durumda enerji fazlası dış ortama ısı biçiminde verilir. Buna karşılık, ham petrolün krakingi (parçalanma) ile elde edilen benzinin oluşumu, enerji soğuran bir tepkimedir: bu durumda tepkin (kimyalsal) maddelerin entalpisi, ürünlerin entalpisinden daha düşüktür.
Termokimya Tepkime Türleri
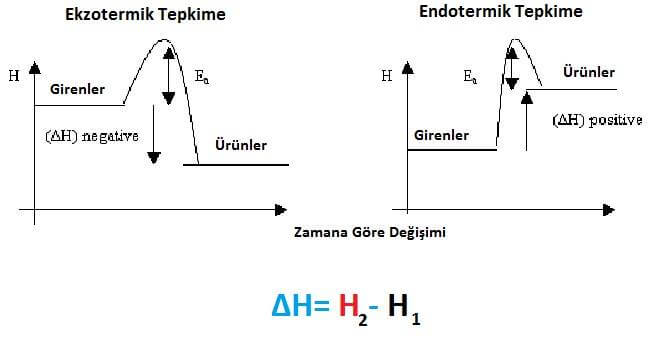
Bunlar ekotermik ve endotermik tepkimelerdir. Isıveren ve ısıalan bu iki tür davranışa, fiziksel hal değişiminde de rastlanır. Deri üzerinde eterin ve benzinin yarattığı soğukluk duygusu, ısı soğurarak buharlaşmasından ileri gelir. Bir tersinir tepkime sırasında üretilen ısı miktarı, ters tepkimeyle tüketilen ısı miktarına eşit değerdedir: hidrojenle oksijenin birleşimi su verir ve çok büyük miktarda enerji açığa çıkarır; buna karşılık suyun hidrojen ve oksijene ayrışması için eşdeğer bir enerji miktarı gerekir. Ama tam anlamıyla suyla çalışan motor ne yazık ki henüz bulunamamıştır!
Tepkime ısıları ısıölçüm (kalorimetri) tekniğiyle deneysel olarak da belirlenebilir. Ayrıca, bu değerler yapılan hesaplarla da bulunabilir. Gerçekte bir kimyasal dönüşüm, tepkin maddelerde atomlar arası bağların kopması ve sonra ürünlerde yeni bağların oluşması sonucunda ortaya çıkar. Bu bağların enerjilerini önceden belirlemek koşuluyla, tepkime ısıları, bu yeni gruplaşmaların enerji bilançosu çıkarılarak hesaplanabilir.
Isıl olmayan çok ender kimyasal tepkimelerde, kopan bağların enerji toplamı, oluşan yeni bağların enerji toplamına tam olarak eşittir ve bu tür tepkimenin ısıl etkisi sıfırdır.
Termokimyanın Temelleri
Bir kimyasal sistemin enerji içeriği bir tepkime sırasında korunur. Bu, termokimyanın temel düşüncesidir.
Bir maddenin içerdiği enerji miktarı doğrudan ölçülemez. Buna karşılık, maddenin dönüşümü sırasındaki değişimi genellikle erişilebilen bir değerdir. Bu değişim dış ortamla ya bir ısı alışverişi, ya da bir iş alışverişi şeklinde gerçekleşir. Bir gaz söz konusu olduğunda, bu iş gazın P basıncı ile ΔV hacim değişimi çarpılarak elde edilir. Bir sistem tarafından alınan enerjiler uzlaşma gereği pozitif ve kaybedilen enerjiler de negatif olarak gösterilir; bu yüzden entalpi formülünde – işareti kullanılır.
Entalpi Formülü
 Kapalı bir kapta, yani hacim değişikliği olmadan uygulanan bir kimyasal tepkimede, dış ortamla iş alışverişi gerçekleşmez. İş ve ısı alışveriş miktarlarının toplamını veren ΔU «iç enerji » değişimi, tepkimenin Q ısısına eşittir. Değişmez hacimde, Q = ΔU eşitliği elde edilir.
Kapalı bir kapta, yani hacim değişikliği olmadan uygulanan bir kimyasal tepkimede, dış ortamla iş alışverişi gerçekleşmez. İş ve ısı alışveriş miktarlarının toplamını veren ΔU «iç enerji » değişimi, tepkimenin Q ısısına eşittir. Değişmez hacimde, Q = ΔU eşitliği elde edilir.
Bununla birlikte, kimyasal tepkimelerin büyük çoğunluğu açık havada, yani değişmez basınç altında gerçekleşir. Bu durumda H büyüklüğü, « entalpi » şöyle belirtilir:
H=U + P • V
Böylece tepkime tarafından üretilen veya soğurulan ısı, basitçe entalpi değişimine eşit olur ve bu değişmez basınçta, Q = ΔH ifadesiyle gösterilir.
Bir maddenin fiziksel veya kimyasal dönüşümü sırasındaki entalpi değişimi, doğrudan doğruya dış ortamla enerji alışverişini ölçer. Bir mol buzun (18 g) 0º sıcaklıkta erimesi 6 kj ısı soğururken (ΔH=6 kj), bir mol metan (16 g) 25 °C sıcaklıkta yanarsa 890 kj ısı açığa çıkarır (ΔH = – 890 kj).
Entalpi değişiminin işareti enerji üreten tepkimelerle (ısıveren), enerji tüketen (ısıalan) tepkimelerin ayırt edilmesini sağlar. Birinci tür tepkimelerde tepkin maddelerin entalpisi, ürünlerin entalpisinden büyüktür. Oysa, enerji farkını dış ortamdan karşılayan ısıalan tepkimelerde bunların entalpisi ürünlerin entalpisinden küçüktür.
Tepkime ısıları sıcaklıkla çok az değişir ve yaklaşık 100 °C’lik bir sıcaklık aralığında değişmez olarak kabul edilebilir. Kimyacı, bir maddenin gerçek «ısıl içeriği» olan entalpi sayesinde, moleküllerin mikroskobik olarak yeniden düzenlenişini uzaktan değerlendirir; böylece atomlar arasında bağların kopması ve yeniden oluşması, çözünen bir cisimle çözücüsü arasındaki etkileşimler vb araştırılır. Bir tepkimenin iç mekanizması korkulacak bir karmaşıklıkta olsa bile, kimyacı bu tepkimenin sonuçlarını öngörebilir.
Termokimya Tepkime Isılarının Hesaplanması
Isı miktarları basitçe toplanıp çıkarılarak bir kimyasal tepkimenin ısıl etkisi büyük bir duyarlılıkla hesaplanabilir.
Bir sistem, bir halden diğerine geçerken entalpi değişimi aynı kalır; bu dönüşümün oluş biçimi entalpi değişimini etkilemez. Karbon dioksit gazını (C02), elde edebilmek için izlenecek iki yol vardır; birinci yolda aşağıdaki tepkime uyarınca karbon yükseltgenir:
C + 1/2 02 —> CO,
bu tepkimedeki entalpi değişimi ΔH = – 109 kj olur, sonra karbon monoksit (CO), yükseltgenir:
CO + 1/2 02—>C02,
buradaki ΔA = – 284 kj’dur. İkinci yoldaysa doğrudan doğruya karbondioksite geçiş görülür:
C + 02—>C02.
Bu sonuncu tepkimeden açığa çıkan enerji, basitçe ilk iki tepkimenin entalpi değişimlerinin toplamına eşittir; yani ΔH = – 393 kj olur.
Bir tepkime tarafından açığa çıkarılan (veya soğurulan) ısı, oluşum ısılarından hareketle de hesaplanabilir; oluşum ısıları, göz önüne alınan cisimlerin her birini ayrı ayrı meydana getirmek için gereken enerji miktarıdır. Ürünlerin oluşum ısıları toplanır ve tepkin maddelerin oluşum ısıları toplamı bu değerden çıkarılır. Mesela, metanın yanma ısısından açığa çıkan enerji, CH4+ 202—>C02 + 2H20 formülüne göre hesaplanır; C02’nin (- 393 kj), H2O’nun (- 286 kj) ve CH4’ün (- 75 kj) oluşum ısılarından hareket ederek şu değere ulaşılır:
– 393 + 2(- 286) – 75 =-890kj
Bileşenlerin içinde bulunduğu fiziksel hal de termokimyasal hesaplamada dikkate alınmalıdır. Nitekim, suyu oksijen ve hidrojenden hareketle elde etmede, su buhar halindeyse 242 kj, sıvı haldeyse 286 kj enerji açığa çıkar, iki değer arasındaki fark olan 44 kj, suyun buharlaşma ısısıdır.
Kimyasal tepkimenin mekanizmasında daha da ayrıntıya gidilebilir. Mesela metanın (CR4) üzerine klorla (Cl2) ornatma tepkimesinde,
CH4 + Cl2 —>CH3CI + HCI ısı miktarı atomların bağ enerjileri kullanılarak hesaplanabilir. Bu tepkime gerçekte metanın bir C – H bağıyla klorun CI – CI bağının kopması ve metil klorürde (soğutucu bir sıvı) C – CI ile hidrojen klorürdeki H – CI bağlarının oluşumu şeklinde açıklanabilir. C – H için 364 kj/mol, CI – CI için 242, C – CI için 278 ve H – CI için 430 olan bu bağ enerjileri arasındaki fark bize doğrudan doğruya aranan enerjiyi verir:
364 + 242 – (278 + 430) =-102 kj/mol.
Bu değer deneysel ölçümlerin verdiği -100 kj/mol değerine oldukça yakındır.
İlginizi çekebilecek diğer yazımız: termodinamik yasaları