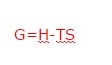Merhaba arkadaşlar bu yazımızda sizlere termodinamik yasaları konu anlatımı yapacağız ve termodinamik yasalarına bağlı olan durumların üzerinde duracağız. Termodinamik nedir? Bildiğiniz üzere termodinamik, maddelerin (ve sistemlerin) arasındaki enerjini inceleyen bir bilim dalı. Parçacıklar arasında enerji alışverişi gerçekleştiğinden dolayı, termodinamik ısı kavramını da ele alır.
Termodinamik Yasaları
Şimdi iki tane katı cisim düşünelim. Bunlar mermerler olabilir. Doğal olarak mermer, soğuk bir katıdır. Çünkü mermeri oluşturan atomlar, neredeyse kıpırdamıyor denilecek kadar az titreşiyorlar. Fakat elimiz mermerden daha sıcak. Çünkü elimizin sıcaklığını arttıran bir enerji kaynağı vardır. Dışarıdan besini alırız, bunu parçalayarak CO2 üretiriz. Karbondioksit üretimi, ekzotermik bir tepkimedir.
Şimdi sıcak olan elinizi, soğuk mermere değdirdiğinizi düşünün. Elinizi değdirdiğiniz t anında ne olacaktır? Bu 2 madde arasında bir enerji alış-verişi olacağı ortada.
Bu alış-veriş kısaca şöyle gerçekleşir: İki sistem arasında, t anında etkileşme başladığında, ısı olandan soğuk olana gerçekleşir. Bu enerji alışverişi, dengelendiğinde durur. Termodinamiğin 2. yasası, entropi ile ilgilenir. Entropi, bir sistemin düzensizliğidir ve zamanın oku yönünde ilerler.
Yukarıdaki görselde, gaz moleküllerinin zaman içinde düzensizliğe uğradığını görüyorsunuz. Aslında evren tek bir yasa üzerine kurulmuştur. Evet, buna benzer bir söz duymuştum. Bu doğrudur. Çünkü evren zamanla birlikte, entropiyle birlikte genişlemektedir. Zaman genişledikçe entropi de artar. Yani evrendeki düzensizlik, hassasiyet artmaktadır. İçinizden ”Evrenin sonu mu geliyor, gözlerime inanamıyorum!” ve ”Acaba evrenin sonu entropiyle açıklanabilir mi?” dediğinizi duyar gibiyim. Canlının yaşlanması, suyun yukarıdan aşağı gitmesi, maddenin bir dış kuvvet olmadıkça soğuması. Bunlar entropi ile açıklanabilir.
Şimdi mermerler örneğine tekrar dönelim. Soğuk olan bu mermer, soğuk kalmaya devam edecek. Çünkü bu cismin sıcaklığını arttıracak bir dış kuvvet yoktur. Lakin mermeri bir fırına koyarsanız, dalga boyunun azalacağını görebilirsiniz. Buradan şu sonun çıkarabiliriz: Bir sistemin, ona dış bir kuvvet etki etmedikçe sıcaklığı artmaz. Çünkü o sistem kendi kendine enerji üretemez. Dış bir kuvvet gerekir.
Termodinamik Yasaları Kısaca
Parçacığın bu sıcaklığına mutlak sıfır denir. Bu sistemde (mermeri örnek alabilirsiniz), entropi minimum değerdedir. Çünkü düzensizliğin artması için, parçacığın bir iç enerjiye sahip olması gerek.
İç enerjiyi U ile gösteririz. O halde mutlak sıfır noktasında U=0 diyebiliriz. Bu sebeple parçacığı daha fazla soğutmak mümkün değildir. Çünkü mutlak sıfır, moleküllerin durduğu noktadır. Aslında madde durmuyor. Tahmin edebileceğimizden çok daha az miktarda titreşim yaparlar. Neredeyse hareket etmedikleri için, bu bir kabuldür. Mutlak sıfır; 0 Kelvin, -274 Celcius, 0 Rankine ve -459 Fahrenheit’e eşittir.
Şimdi biraz daha ayrıntıya inelim. Mermer, içinde çok küçük olsa da enerji depolar. Mermerin içinde depoladığı her türlü enerjilerin toplamına entalpi denir. H ile simgelenir. Değişen entalpiyi ΔH ile gösterebiliriz.
Şimdi de, kimyasal bir tepkime düşünelim. Bir tepkimede, ürünleri oluşturanlar, yani reaktanlar (reaksiyona girenler) vardır. Günümüz bilgisi şunu söyler: Ürünlerin entalpileri toplamı ile reaktanların entalpileri toplamı arasındaki farka, tepkimenin entalpi değişimi denir. Yani ΔH.
ΔH=U+Pe
Pe: Parçacığın potansiyel enerjisidir.
Şimdi, lise 1 bilgilerinizden bir sonuca varacağız. Bir tepkime gerçekleşirken, t anında ısı artıyorsa, bu bir endotermik tepkimedir (ısı alan anlamında). Eğer ısı veriyorsa (aynı zamanda ışıma da yapar), bu bir ekzotermik tepkimedir.
ΔH>0 ise bu endotermik bir tepkimedir. Çünkü sıcaklığı sıfırdan büyüktür.
ΔH<0 ise, bu tepkime ekzotermik diyebiliriz. Çünkü tepkimede ısı kaybı yaşanmaktadır.
Bu arada, entalpideki değişimi formülize edelim.
ΔH=Son durumdaki iç enerji-İlk durumdaki iç enerji
Yani, ΔH=Ürünlerin iç enerjsi-reaktanların iç enerjisi
Entalpiden, entalpi ve mutlak sıcaklığın çarpımının çıkarılmasıyla elde edilen termodinamik bir değişken vardır. Bu değişken Gibbs Enerjisidir. G ile gösterilir.
Bu denklemden, biraz sonra bazı sonuçlar elde edeceğiz.
Toplam entropi, sistemin entropisiyle çevrenin entropisinin toplamına eşittir.
ΔSe: Evrendeki (toplam) entropi
ΔSc: Çevredeki entropi
ΔSs: Sistemin entropisi
Bir sistem, ona dış bir kuvvet etki etmedikçe soğuktan sıcağa akamayacağından çevrenin entropisindeki değişim:
-ΔH(s)/T ifadesine eşittir.
Bir reaksiyonun ΔG<0 olduğu anda o reaksiyon, ürünler yönünde gerçekleşir. Çünkü enerji, reaksiyonun gerçekleştiği yöndedir.
ΔG=o ise denge sağlanır. Yani iki cisim de ısısal dengeleşmeye girmiştir.
ΔG>0 olduğunda, ısı dengesi bozulur. Reaksiyonlar, kendiliğinden ürünler yönünde hareket edemez. Yani bir tepkime kendi kendine oluşamaz.
Bu konuları, katılardan daha karmaşık olan gazlar üzerinde düşünebiliriz. Maxwell, 19. yy’da düşünsel bir deney geliştirmiştir. Bu deney termodinamik yasaları ile çelişmekle beraber, kafamızın karışmasına neden olur. Bu yazımızda sizlere termodinamik yasaları konu anlatımı yaptık. Diğer yazımızda görüşmek üzere.