Termodinamik, enerji ile ilgilenen temel bilimlerden biridir ve mühendislik eğitimininde temel öğelerinden biridir. Bilindiği üzere Termodinamiğin 4 temel yasası vardır. Termodinamiğin 2. yasası nedir? Bu 4 yasadan içerisinden termodinamiğin ikinci yasası entropiye göre; “ısı daima sıcak cisimden soğuk cisime doğru akar.” Buna bilinen basit bir örnek verecek olursak masa üzerine bırakılan bir bardak sıcak çay kısa sürede soğur. Ve bu durum birinci yasaya göre de aykırı değildir.
Çünkü çayın kaybetmiş olduğu enerji, havanın kazanmış olduğu enerjiye eşittir. Ancak bu durum tam tersi olsaydı. Yani çayın ortamdan alacağı ısı ile soğumak yerine ısınması. Böyle bir durum olmayacağını biliyoruz, fakat olsaydı, bu sefer havanın kaybetmiş olduğu enerji, çayın kazanmış olduğu enerjiye eşit olacağından dolayı yine birinci yasaya aykırı olmazdı.
Termodinamiğin 2. yasası hal değişimlerine uygulanmasıyla birlikte entropi denilen yeni bir tanıma yol açar. Ve Clasius eşitsizliği bu yeni tanım için temel oluşturur. Bu eşitsizlik şöyle ifade edilir:
∮SQ/T≤0 (kJ/K)
Bu eşitsizlik ifadesine göre SQ/T’nin termodinamik çevrim üzerinde integrali sıfıra eşit veya yakındır. Bu eşitsizlik tüm tersinir veya tersinmez çevrimler için geçerlidir. Eşitlik, içten veya tüm tersinir hal durumları için, eşitsizlik ise tersinmez hal durumları için geçerlidir.
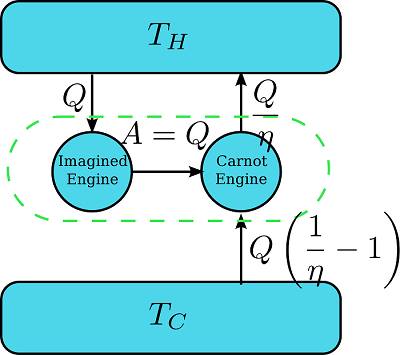
Entropi ise bu clasius eşitsizliğine bağlıdır. Ve entropi bir sistemde mekanik işe dönüştürülemeyen faydasız enerjiyi temsil etmektedir. Ve genellikle sistemdeki düzensizlik olarak tanımlanır. Entropiye göre herşey yıpranır. Canlılar doğar, büyür ve ölür, eşyalar eskir ve evrenimizdeki düzensizlik artar. Ve bu düzensizlik entropi ile ölçülür. Sistemdeki faydalı enerji azaldıkça, faydasız enerji olan entropi artar. Entropiyi tanımlamak için gerekli denklem aşağıdadır:
dS=(SQ/T)_(içten tersinir) (kJ/K)
Bir hal değişimi anında entropide ki değişim yukarıdaki bağıntıyla birleştirilerek bulunabilir:
∆S=S1-S2
Ve buna bağlı olarak içten tersinir ve sabit sıcaklıktaki durumda sonuç:
∆S=Q/T_0 (kJ/K)
Olur. Ve bu denklem Clasius eşitsizliğiyle birleştirildiğinde, entropinin artış ilkesi denilen eşitsizlik elde edilir. Bu eşitsizlik:
dS≥SQ/T
Veya
S_üretim=∆S_toplam=∆S_sistem+∆S_çevre≥0
Denklemde görüldüğü üzere bir sistemde enerjinin hal değişimlerindeki entropi ve çevre değişimlerinin toplamı pozitiftir. Buda entropinin sürekli olarak artmasına neden olur. Bir sistemde entropinin sıfır olarak kabul edildiği tek bir nokta vardır. Buda mutlak sıfır dediğimiz -273,15 (0 Kelvin ) sıcaklıktır. Bu nokta referans alınır ve mutlak entropi adı verilir. Aynı zamanda termodinamiğin 3. Yasası olarakta kabul edilir. Big bang’den bu tarafa evrenin sıcaklığı -273,15 dereceye yaklaşma eğilimindedir. Bunu bir örnekle açıklayacak olursak içerisi sıvı dolu olan bir bardak yere düşürülüp kırıldığında bardak ve sıvının ilk halindeki düzeni bozulur. Parçalanan bardak tekrardan ilk halindeki zamana dönemez, yani düzensizlik sürekli olarak bir sonraki zamandadır.
Aşağıdaki hareketli görselden daha iyi anlayabilirsiniz.
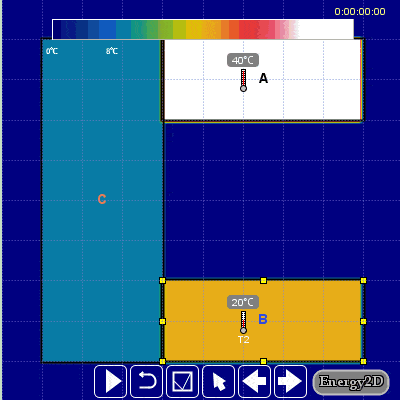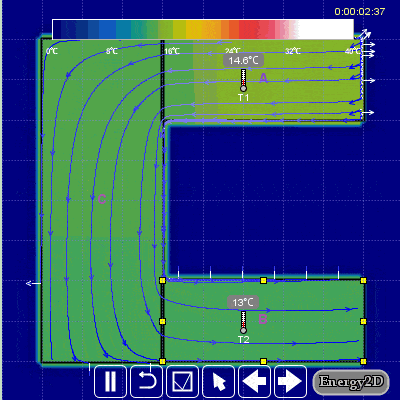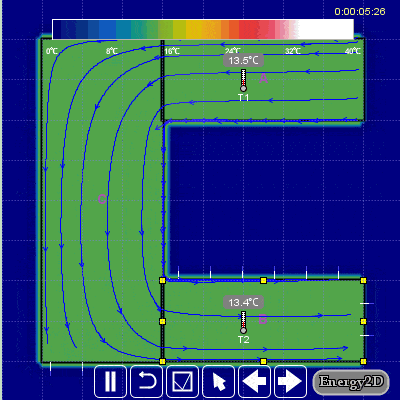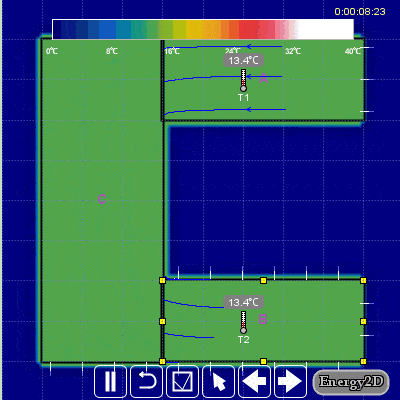
Günlük hayatımızda da entropinin üretimi ile ilgili bir örnek verecek olursak iki kişi herhangi bir sebepten dolayı bir anlık öfkeyle kavgaya tutuşurlarsa sonuçları kötü ve onarılamaz hasarlara neden olabilir ve entropi üretirler. Öfkeyle kalkan zararla oturur. Entropi bir bakıma düzensizlik içinde bir düzendir.
İlginizi çekebilecek diğer ilgili yazı; Termodinamik yasaları konu anlatımı



