Merhaba arkadaşlar bu yazımızda sizlere termodinamiğin 1. yasası ve termodinamiğin birinci kanunu ile ilgili bazı uygulamaları sizlere anlatacağım. Bir sistemin mekanik enerjisi sürtünme gibi korunumlu olmayan kuvvetlerin bulunmaması halinde geçerlidir. Yani mekanik modelde, bir sistemin iç enerji değişimi eklememişti. Termodinamiğin birinci kanunu, enerji korunumu kanununun bir genelleştirilmelidir ve iç enerjideki muhtemel değişmeleri de kapsar. Termodinamiğin birinci kanunu bütün işlemlere uygulanabilen evrensel bir yasadır. Ayrıca, mikroskobik ve makroskobik nicelikler arasında ilişki de kurar.
Bir sistem ile çevresi arasındaki enerji alış verişinin iki yolla olduğunu gördük. Bunlardan biri, sistem tarafından iş yapmaktır. Bu tür enerji değişiminde, sistemin makroskobik değişkenlerinde, yani basınç veya kuvvetin uygulama noktasının yerinde kayda değer bir değişme olur. Diğeri ise mikroskobik düzeydeki sistemin molekülleri arasındaki rastgele çarpışmalardan ileri gelen ısı transferidir. Her iki mekanizma, sistemin iç enerjisinde bir değişmeye yol açar ve bu nedenle de, sistemin basınç, sıcaklık ve hacim gibi makroskobik değişkenlerinde ölçülebilir değişmeler oluşur.
Bu düşünceleri daha nicel bir temele oturtmak için, termodinamik bir sistemin bir ilk halden son hale Q birimlik ısı alış verişi yaparak ve sistem tarafından veya sistem üzerinde W işi yapılarak geçtiğini farz edelim. Örneğin sistem, basınç ve hacmi Pi, Vi den Ps, Vs ye değişen bir gaz olsun. Eğer Q-W nicelikleri, ilk ve son denge durumlarını birleştiren çeşitli yollar boyunca ölçülmüş ise, görülür ki ilk ve son durumu birleştiren bütün yollar boyunca bulunan Q-W değerleri aynıdır. Buradan, bir sistemin ilk ve son durumu vasıtası ile, Q- W niceliğinin tamamen belirlenebilir olduğu sonucuna varırız. Q-W niceliği bir sistemin iç enerjisindeki değişmedir. Q ve W nün her ikisi de yola bağlı olmasına rağmen, Q-W niceliği yoldan bağımsızdır. İç enerji fonksiyonunu Eiç harfi ile gösterirsek, iç enerjideki ΔEiç değişimi şeklinde ifade edilebilir.
ΔEiç = Q – W (20.9)
Buradaki bütün nicelikler aynı enerji birimi ile ifade edilmelidir. 20.9 Eşitliği, termodinamiğin birinci kanunu olarak bilinir. Kanun bu biçimi ile kullanıldığında, sisteme bir enerji girerse Q pozitif, sistem çevresi üzerine bir iş yaparsa W pozitif alınır. Sistem üzeride çevresi bir iş yaparsa W negatif olur.
Bir sistem, sonsuz küçük bir hal değişimine maruz kalırsa, çok küçük miktarda dQ enerjisi transfer edilir ve çok küçük bir dW işi yapılır ve iç enerji değişimi dEjç de çok küçük olur. Böylece, birinci kanun sonsuz küçük işlemler için
dEiç = dQ – dW
şeklinde ifade edilir. Birinci kanundaki eşitlik, bir enerji korunumu ifadesidir; ve sistemde değişen tek enerji türünün E olacağını söyler. Şimdi bu şartları taşıyan bazı özel durumlara bakalım.
Önce, yalıtılmış bir sistem inceleyelim. Yani, sistem çevresi ile etkileşmiyor olsun. Bu durumda, bir ısı akışı yoktur ve yapılan iş sıfırdır. Dolayısıyla, iç enerji sabit kalır. Yani, Q = W= 0 olduğundan ΔEiç = 0 dır ve böylece Eiç,i = Eiç,s olur. Buradan, yalıtılmış bir sistemin iç enerjisi Eiç sabit kalır sonucuna varırız.
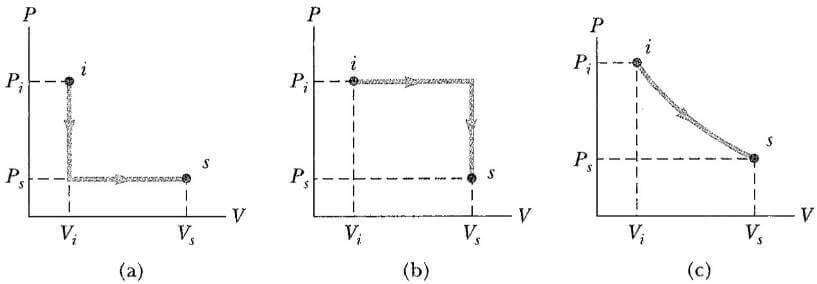
İkinci olarak, çevrimli (devirli) işlem yapan bir sistemi (çevresinden yalıtılmış) ele alalım. Yani, sistem bir durumda iken, belirli bir işlem başlar ve biter. Bu durumda, iç enerjideki değişim sıfırdır ye çevrim sırasında yapılan iş, sisteme verilen ısı miktarına eşit olmalıdır. Yani, çevrimli işlemlerde (süreçlerde) yazılabilir.
ΔEiç = 0 ve Q = W
PV diyagramında bir çevrim, kapalı bir eğri olarak görünür (Şek. 20.5’te gösterilen süreçler açık eğrilerle temsil edilmiştir. Çünkü ilk ve son durumlar farklıdır.) Buna göre çevrim sürecinde, çevrim başına sistem tarafından yapılan iş PV diyagramında ki kapalı yolun çevrelediği alana eşittir.
Herhangi bir süreçte sistemin yaptığı iş sıfır ise, iç enerjideki ΔEiç değişimi, sisteme verilen veya ondan alman Q enerjisine eşittir:
ΔEiç = Q
Sisteme bir enerji girerse, Q pozitif olur ve sistemin iç enerjisi artar. Gazlarda, sistemin iç enerjisi arttıkça gaz moleküllerinin kinetik enerjisi artar. Tersine, işlem sırasında enerji transferi yok ise, fakat sistem tarafından bir iş yapılırsa, iç enerjideki değişim sistemin yaptığı işin negatif işaretlisine eşit olur:
ΔEiç = -W
Örneğin; Bir gaz, yalıtılmış bir silindirdeki pistonu hareket ettirerek sıkıştırılırsa, ısı yolu ile transferi almaz ve gazın yaptığı iş negatif olur. O halde, piston hareket ettirilerek gaz moleküllerine bir kinetik enerji transferi olduğundan iç enerji artacaktır.
Mikroskobik ölçekte ısı ve iş arasında gerçekte bir fark yoktur. Her ikisi de sistemin iç enerjisinde bir değişmeye neden olur. Q ve W makroskobik niceliklerinden her ikisi de sistemin bir özelliği değilse de, termodinamiğin birinci kanunu yolu ile sistemin iç enerjisi ile ilişkilidirler. Bir işlemde Q ve W bir kez ölçülür veya hesaplanırsa, termodinamiğin Birinci kanununu kullanarak iç enerji değişimi bulunabilir.
Birinci Kanunun en önemli sonuçlarından birisi, iç enerji denilen bir niceliğin var oluşudur. İç enerjinin değeri, sistemin durumundan tayin edilir. Dolayısıyla, iç enerji fonksiyonuna durum (hâl) fonksiyonu denir.
Termodinamiğin Birinci Kanunu ile İlgili Bazı Uygulamalar
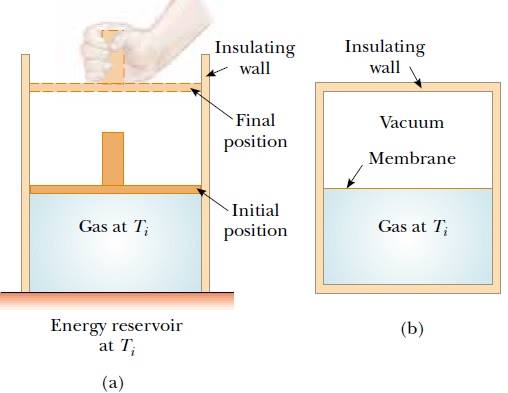
Termodinamiğin birinci kanununu özel sistemlere uygulamaya başlamadan, önce bazı yaygın termodinamik işlemleri tanımlamak yararlı olur. Bir sistemin ısıl değişim sürecinde, hiç bir ısı girişi veya ısı çıkışı olmuyorsa, yani Q = 0 ise, böyle bir sürece adyabatik süreç denir. Adiyabatik bir süreç, ya çevreden yalıtılmış bir sistem kullanılarak ya da ısı yolu ile enerji kaçamayacak kadar kısa bir süre yapılırsa gerçekleştirilebilir (Şekil 20.6b). Termodinamiğin birinci kanunu böyle bir sürece uygulandığında
ΔEiç = -W (adyabatik süreç) (20.10)
olur.
Bu sonuçtan görüldüğü üzere, gaz adyabatik olarak genleşirse W pozitif olur. Dolayısıyla ΔEiç in değeri de negatif olur ve gazın sıcaklığı düşer. Ters bir işlemde, yani bir gaz, adyabatik olarak sıkıştırılırsa gazın sıcaklığı artar.
Adyabatik işlemler mühendislik uygulamasında çok önemlidir. İçten yanmalı bir motorda sıcak gazın genleşmesi, soğutma sistemlerinde gazların sıvılaşması ve dizel motorlarda sıkıştırma vuruşu adyabatik işlemlere gösterilebilecek örneklerden bazılarıdır.
Şekil 20.6b’de anlatılan adyabatik serbest genleşme işlemi, gerçekleşen tek işlemdir. İşlem, yalıtılmış bir kap içinde gerçekleştiği için adyabatiktir. Gaz boşluk içinde genleştiği için, Şekil 20.6a’da olduğu gibi pistona kuvvet uygulamaz ve sonuç olarak ne gaz, üzerine, ne de gaz tarafından iş yapılır. Sonuç olarak bu adyabaltik işlemde Q = 0 ve W= 0 olduğundan birinci kanuna göre ΔEiç = 0 olduğunu görürüz. Yani, adyabatik serbest genleşmeler de bir gazın ilk ve son iç enerjileri birbirine eşittir. Bir sonraki bölümde göreceğiz ki, ideal bir gazın iç enerjisi yalnızca gazın sıcaklığına bağlıdır. Böylece, serbest adyabatik genleşmeler de gazın sıcaklığında bir değişme beklenmez. Bu kestirim düşük basınçlarda yapılan deneylerle uyum halindedir (Gerçek bir gazla yüksek basınç altında dikkatlice yapılan deneylerde, genleşme den sonra gaz sıcaklığının biraz azaldığı görülür. Bu değişme, moleküller arası etkileşmelerden kaynaklanır ve ideal gaz modelinden olan bir sapmayı temsil eder).
Sabit basınç altında meydana gelen işlemlere izobarik işlemler denir. Böyle bir işlem meydana geldiğinde, transfer edilen ısı ve yapılan iş sıfırdan farklıdır. Yapılan iş, kısaca burada P sabit basınçtır.
W = P(Vs – Vi) (izobarik işlem) (20.11)
Sabit hacim altında meydana gelen işlemlere eş hacimli işlemler denir. Böyle bir işlemde yapılan iş açıkça sıfırdır. Çünkü hacim değişmiyor. O halde, Birinci kanuna göre W= 0 olduğundan olur.
ΔEiç = Q (eşhacimli işlem) (20.12)
Bu bize, hacmi sabit tutulan bir sisteme ısı verildiğinde, verilen ismin tamamının sistemin iç enerjinin artışına gittiğini söyler. Örneğin, bir sprey kutusu ateşe atıldığında, sisteme (kutudaki gaza) kutunun metal duvarlarından ısı yolu ile enerji girer. Sonunda, kutudaki sıcaklık, dolayısı ile de basınç, kutu patlayıncaya kadar artar.
Sabit sıcaklıkta meydana gelen işlemlere eş sıcaklık (izotermal) işlemleri denir. Bir ideal gazın, sabit sıcaklık işlemlerinde P-V eğrisi hiperbolik bir eğridir ve buna izoterm adı verilir. İdeal bir gazın iç enerjisi yalnızca sıcaklığın bir fonksiyonudur. Buna göre, bir ideal gazın izotermal işleminde ΔEiç = 0 olur. Yani, gaza verilen Q kadarlık enerji, gaz tarafından yapılan işe eşit olur; yani Q = W dir. Demek ki, ısı yolu ile giren enerji, sistemden iş olarak çıkar. Sonuçta, sistemin iç enerjisinde bir değişme olmaz.
Kaynak: Serway Fizik Kitabı
Konu ile ilgili diğer bir yazımız; Termodinamiğin 2. yasası – Entropi Nedir