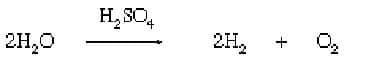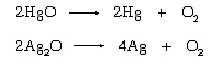Oksijen, (“Octium”) periyodik tabloda 16A grubunda bulunan 8 atom numarasına sahip kimyasal bir elementtir. Element çok yaygındır, sadece Dünya’da değil, evrende de bulunur. metalik olmayan kimyasal elementi. Dünyadaki oksijen molekülü (O2) (genellikle serbest oksijen olarak adlandırılır) termodinamik olarak kararsızdır. Oksijen, canlı organizmalar için gerekli olan ve hayvanlar tarafından karbondiokside (CO2)dönüştüren, renksiz, kokusuz, tatsız bir gazdır; bitkiler de karbon kaynağı olarak karbondioksit kullanır ve oksijeni atmosfere geri dönüştürür. Oksijen, hemen hemen bir çok elementle reaksiyona girerek yeni bileşikler oluşturur; birçok durumda, bu süreçlere ısı açığa çıkar ve bu gibi durumlara yanma denir. En önemli bileşiği sudur (H2O).
Oksijenin Özellikleri Nelerdir
Normal şartlar altında oksijen, iki oksijen atomundan oluşan bir gaz olarak bulunur, kimyasal formül O2‘dir. Oksijen, fotosentez sırasında bitkiler tarafından üretilen havanın önemli bir bileşenidir ve hayvanların solunumu için gereklidir. Oksijen kelimesi Yunanca iki kelimeden, Yunanca “oxus” ve “geinomai” den türetilmiştir. Genel kütlenin yüzde 46’sını oluşturan oksijen, Dünya’nın kabuğundaki en bol elementtir. Atmosferdeki hacimce oksijen oranı yüzde 21, deniz suyunda ağırlıkça yüzde 89’dur.
| Oksijenin Genel Özellikleri | |
|---|---|
| Sembol, Atom Numarası | Oksijen, O, 8 |
| Grup | ametaller |
| Grup, Periyod, Blok | 16 (VA), 2 , p |
| Yoğunluk, Sertlik | 1.429 kg/m3(273K), NA |
| Görünüm | renksiz |
| Oksijenin Atom Özellikleri | |
| Atom ağırlığı | 15.9994 amu |
| Atom yarıçapı | 60 (48) pm |
| Kovalent yarıçapı | 73 pm |
| Van der Waals yarıçapı | 152 pm |
| Elektron konfigürasyonu | [He]2s22p4 |
| e–s başına enerji miktarı | 2, 6 |
| Oksidasyon derecesi | -2, -1 (nötr) |
| Kristal yapısı | kübik |
| Oksijenin Fiziksel Özellikleri | |
| Maddenin hali | gaz (paramanyetik) |
| Erime noktası | 50.35 K (-368.77 °F) |
| Kaynama noktası | 90.18 K (-297.08 °F) |
| Molar hacim | 17.36 ×10-6 m3/mol |
| Buharlaşma ısısı | 3.4099 kJ/mol |
| Füzyon ısısı | 0.22259 kJ/mol |
| Buhar basıncı | – |
| Ses hızı | 317,5 m/s, 293 [K] |
| Oksijenin Diğer Özellikleri | |
| Elektronegativite | 3.44 ((Pauling ölçeği)) |
| Özgül ısı kapasitesi | 920 J/(kg*K) |
| Elektriksel iletkenlik | – |
| Termal iletkenlik | 0.02674 W/(m*K) |
| 1. iyonlaşma potansiyeli | 1313.9 kJ/mol |
| 2. iyonlaşma potansiyeli | 3388.3 kJ/mol |
| 3. iyonlaşma potansiyeli | 5300.5 kJ/mol |
| 4. iyonlaşma potansiyeli | 7469.2 kJ/mol |
| SI sistemi kullanılmıştır. | |
Oksijen Ne Zaman Bulundu
Oksijen, 1772 yılında İsveçli bir kimyager Carl Wilhelm Scheele tarafından potasyum nitrat, cıva oksit ve diğer birçok maddeyi ısıtarak elde edildi.
Bir İngiliz kimyager Joseph Priestley, 1774 yılında merkürik oksidin veya diğer bir deyişle civa oksidin (HgO) termal ayrışmasıyla oksijeni bağımsız olarak keşfetti ve bulgularını Scheele’nin yayınlanmasından üç yıl önce aynı yıl yayınladı. 1775-80’de Fransız kimyager Antoine Lavoisier, o zamana kadar kabul edilmiş olan filojiston teorisini (şimdi bir geçerliliği yok) göz önüne alarak kayda değer bir içgüdü ile oksijenin solunum ve yanmadaki rolünü yorumladı; birçok farklı madde ile birleşerek asit oluşturma eğilimine dikkat çekti ve buna göre Yunanca “asit oluşturucu” kelimesinden oxygène(oksijen) adını verdi.
Oksijenin Allotropları
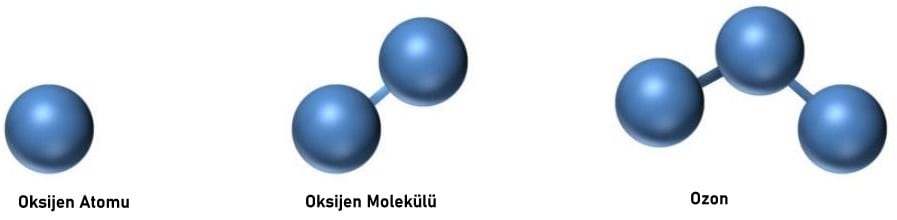
Oksijenin iki allotropik formu vardır, diyatomik (O2) ve triatomik (O3, ozon). Diyatomik formun özellikleri, altı elektronun atomları bağladığını ve iki elektronun eşleşmediğini ve oksijenin paramanyetizmasını açıkladığını gösterir. Ozon molekülündeki üç atom düz bir çizgi boyunca uzanmaz.
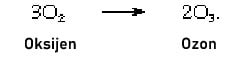
Ozon, aşağıdaki denkleme göre oksijenden üretilebilir:
Süreç, yazıldığı gibi endotermiktir (ilerlemesi için enerji sağlanmalıdır); ozonun tekrar diatomik oksijene (O2) dönüşümü, geçiş metallerinin veya oksitlerinin varlığı ile desteklenir. Saf oksijen kısmen sessiz bir elektrik deşarjı ile ozona dönüştürülür; reaksiyon ayrıca 250 nanometre (nm, nanometre, 10−9 metreye eşit) dalga boylarındaki ultraviyole ışığın emilmesi ile de sağlanır; bu işlemin üst atmosferde meydana gelmesi, Dünya yüzeyinde yaşam için zararlı olabilecek radyasyonu ortadan kaldırır. Jeneratör odalarında olduğu gibi, elektrikli ekipmanların kıvılcımının olduğu kapalı alanlarda ozonun keskin kokusu fark edilir. Ozon açık mavidir; yoğunluğu havanın yoğunluğunun 1.658 katıdır ve atmosfer basıncında -112 ° C (−170 ° F) kaynama noktasına sahiptir. Ticari olarak ozon, kimyasal bir reaktif olarak, dezenfektan olarak, kanalizasyon arıtma, su arıtma ve ağartma tekstillerinde kullanılmıştır.
Oksijenin Üretim Yolları
Oksijen için seçilen üretim yolları, istenen elementin miktarına bağlıdır. Laboratuvar prosedürleri aşağıda gösterilmiştir:
1. Potasyum klorat veya potasyum nitrat gibi bazı tuzların termal ayrışması:
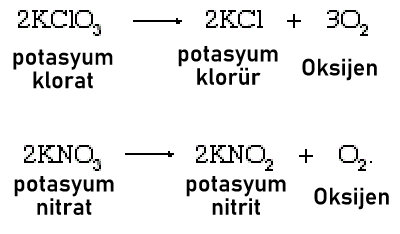 Potasyum kloratın ayrışması, geçiş metallerinin oksitleri tarafından katalize edilir; manganez dioksit (pirolusit, MnO2) sıklıkla kullanılır. Oksijenin üretimini gerçekleştirmek için gerekli sıcaklık katalizör tarafından 400 ° C’den 250 ° C’ye düşürülür.
Potasyum kloratın ayrışması, geçiş metallerinin oksitleri tarafından katalize edilir; manganez dioksit (pirolusit, MnO2) sıklıkla kullanılır. Oksijenin üretimini gerçekleştirmek için gerekli sıcaklık katalizör tarafından 400 ° C’den 250 ° C’ye düşürülür.
2. Tuz veya asit içeren suyun elektrolizi (elektrik akımının iletildiği iyon dengesi):
3. Ağır metal oksitlerin termal ayrışması:
4. Metal peroksitlerin veya hidrojen peroksidin termal ayrışması:
Elektronegatifliği nedeniyle, oksijen hemen hemen diğer tüm elementlerle (orijinal oksidasyon tanımının kaynağı olan) kimyasal bağlar oluşturur. Oksidasyon olasılığından kaçan tek elementler soy gazlardan birkaçıdır. Bu oksitlerin en ünlüsü elbette hidrojen oksit veya sudur (H2O). İyi bilinen diğer örnekler arasında karbondioksit (CO2), alkoller (R-OH), aldehitler, (R-CHO) ve karboksilik asitler (R-COOH) gibi karbon ve oksijen bileşikleri yer alır. Kloratlar (ClO3–), perkloratlar (ClO4–)), kromatlar (CrO42-), dikromatlar (Cr2O72), permanganatlar (MnO4–) ve nitratlar (NO3–) gibi oksijenli radikaller kendi başlarına güçlü oksitleyici faktörlerdir.
Oksijen Karşısında Alınabilecek Önlemler
Oksijen, yüksek kısmi basınçlarda toksik olabilir. Ozon (O3), hidrojen peroksit, hidroksil radikalleri ve süperoksit gibi bazı oksijen türevleri de oldukça toksiktir. Vücut bu toksik türlere karşı koruma mekanizmaları geliştirmiştir. Örneğin, doğal olarak oluşan glutatyon, normalde hemoglobinin bir parçalanma ürünü olan bilirubin gibi bir antioksidan görevi görebilir. Yüksek konsantrasyonlu oksijen kaynakları hızlı yanmaya meyillidir ve bu nedenle yakıtların içeriklerinde kullanılır, yangın ve patlama riskleri vardır. (kloratlar, perkloratlar, dikromatlar vb.) Yüksek oksidatif potansiyele sahip bileşikler genellikle kimyasal yanıklara neden olabilir.
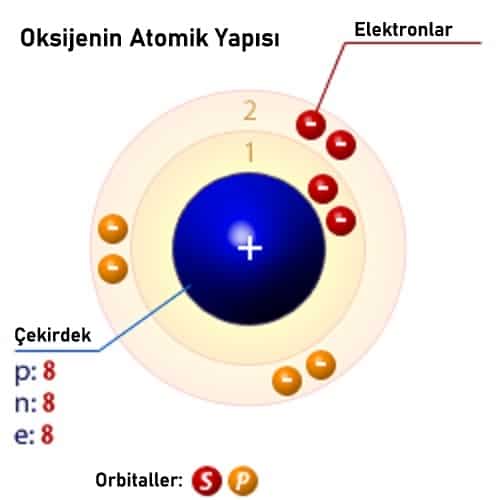
Oksijenin Atomik Yapısı
Moleküler olarak (O2), normal (ortam) sıcaklıklarda ve basınçlarda özellikle reaktif değildir. Atomik olarak O, çok daha reaktiftir. Ayrılma enerjisi (O2 → 2O) mol başına 117.2 kilokaloridir. Ek olarak bu bilgiyi de ekleyelim: Evren’in %1’i, Güneş’in %0.9’u Dünya okyanuslarının %86’sı insan vücudunun %61′ oksijen oluşmaktadır.