Bir maddenin basıncı, sıcaklığı ve özgül hacmi arasındaki ilişkiyi veren herhangi bir bağıntıya hal denklemi adı verilir. Denge halinde bir maddenin diğer özelikleri arasındaki ilişkileri veren bağıntılara da hal denklemi denir. Bazıları basit bazıları çok karmaşık olan birçok hal denklemi vardır. Bu denklemlerin en basit ve en çok bilineni mükemmel gaz hal denklemidir. Bu denklem belirli sınırlar içinde gazların P-v-T ilişkisini oldukça hassas bir biçimde verir.
Gaz ve buhar sözcükleri genellikle aynı anlamda kullanılır. Bir maddenin buhar fazı, sıcaklık kritik sıcaklığın üzerindeyse gaz diye adlandırılır. Buhar genellikle yoğuşma sınırına yakın bir gazı niteler.
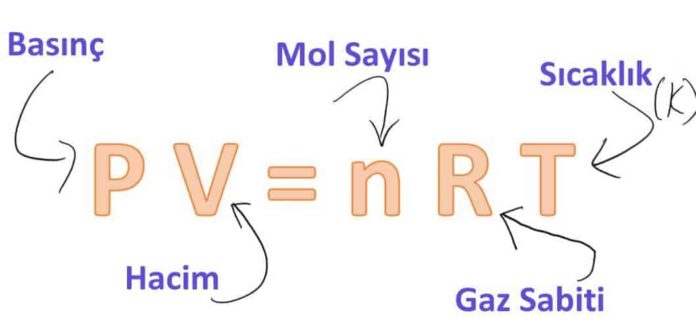
Bir İngiliz fizikçisi olan Robert Boyle, 1662 yılında vakum odasında yaptığı deneylerde, bir gazın basıncının hacmiyle ters orantılı olarak değiştiğini gözledi. 1802 yılında Fransız J. Charles ve J. Gay-Lussac düşük basınçlarda, bir gazın hacminin sıcaklıkla orantılı olduğunu deneysel olarak buldular. Böylece aşağıdaki bağıntıyı (Şekil 1) elde ettiler.
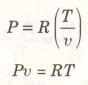
Burada R, orantının denkleme dönüştürülmesi sırasında ortaya çıkan ve gaz sabiti adı verilen çarpandır. Şekil 1’deki denklem mükemmel gaz hal denklemi diğer adıyla ideal gaz denklemi olarak bilinir ve bu denkleme uyan gazlar mükemmel gaz (ideal gaz) diye adlandırılır. Bu denklemde P mutlak basıncı, T mutlak sıcaklığı, v ise özgül hacmi göstermektedir.
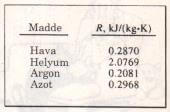
Gaz sabiti R’nin her gaz için farklı bir değeri vardır (Şekil 2) ve aşağıdaki bağıntı ile hesaplanır (Şekil 3).
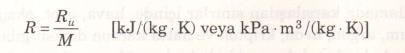
Burada Ru üniversal gaz sabiti, M ise söz konusu gazın mol kütlesi veya bir başka deyimle moleküler ağırlığıdır. Ru sabitinin değeri tüm maddeler için aynıdır ve aşağıda değişik birimlerde verilmiştir.

Mol kütlesi M, gram olarak maddenin bir molünün kütlesidir. Aynı zamanda gram-mol veya kısaca gmol olarak da bilinir. Kilogram olarak maddenin bir kilomolünün kütlesi de (kmol) aynı değeri verir. İngiliz birimlerinde mol kütlesi bir libre-molun (lbmol) libre olarak kütlesidir. (1 lbmol = 0.4536 kmol). Dikkat edilirse her iki birim sisteminde de mol kütlesi aynı sayısal değere sahiptir. Örneğin, azotun mol kütlesi 28’dir dendiği zaman, 1 kmol azotun kütlesinin 28 kg olduğu veya llbmol azotun kütlesinin 28 lbm olduğu belirtilmiştir. Başka bir deyişle, 28 kg/kmol = 28 lbm/lbmol. Bir maddenin kütlesi, M ile gösterilen mol kütlesi ve n ile gösterilen mol miktarının çarpımına eşittir.
n=Mn (kg)
Mükemmel gaz hal denklemi birkaç değişik biçimde yazılabilir.
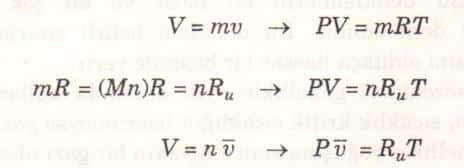
Burada v , mol özgül hacmi veya birim molun hacmidir (m3/kmol veya ft /lbmol).
V=mv denklemi iki kez yazıp sadeleştirerek, bir mükemmel gazın iki değişik haldeki özelikleri arasında bir bağ kurabiliriz.
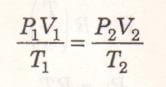
Mükemmel gaz aslında Pv = RT denklemini sağlayan sanal bir maddedir. Yukarıda verilen mükemmel gaz bağıntısının düşük yoğunluklardaki gerçek gazların P-v-T ilişkisini oldukça yakın bir biçimde ifade ettiği, deneysel olarak saptanmıştır. Düşük basınç ve yüksek sıcaklıklarda bir gazın yoğunluğu azalır ve mükemmel gaz gibi davranır. Düşük basınç ve yüksek sıcaklıkların ne anlama geldiği aşağıda açıklanacaktır.
Uygulamada karşılaşılan sınırlar içinde, hava, azot, oksijen, hidrojen, helyum, argon, neon, kripton ve hatta karbon dioksit gibi daha ağır gazlar yüzde birden daha az bir hatayla mükemmel gaz olarak kabul edilebilir. Fakat buharlı güç santrallerindeki su buharı ve buz dolaplarındaki soğutucu akışkan buharları gibi yoğun gazlar, mükemmel gaz kabul edilmemelidir. Bu maddeler için özelik tabloları (buhar tabloları) kullanılmalıdır.