Merhaba arkadaşlar bugün sizlere moleküller bağlar ve çeşitlerini (iyonik bağ, kovalent bağ, hidrojen bağı ve van der waals bağı) anlatacağım. Kararlı bir molekülün toplam enerjisi, ayrık haldeki atomların toplam enerjisinden daha küçüktür. Esas itibariyle bir molekülde ki bağlanma, öncelikle atomlar (veya iyonlar) arasındaki elektrostatik etkileşme kuvvetlerine dayanır. İki atom arasındaki uzaklık sonsuz iken, aralarındaki kuvvet ve sistemin elektrostatik potansiyel enerjisi sıfırdır. Atomlar birbirlerine yaklaştırıldığında, çekici ve itici kuvvetlerin her ikisi de etkili olur. Çok büyük uzaklıklarda, etkili olan kuvvetler çekici özelliktedir. Küçük uzaklıklarda, yükler arasında olduğu gibi, itici kuvvetler baskın olmaya başlar.
Atomlar arasındaki uzaklığa bağlı olarak, sistemin potansiyel enerjisi artı (pozitif) veya eksi (negatif) olabilir, sistemin toplam enerjisi yaklaşık olarak
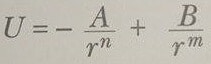
eşitliği ile verilebilir. Burada r çekirdekler arası uzaklık, A ve B çekici ve itici kuvvetler ile ilgili sabitler ve n ve m küçük tamsayılardır. Şekil 1, toplam potansiyel enerjinin, çekirdekler arası uzaklığa göre değişimini göstermektedir. Çekirdekler arası uzaklık büyükse, eğrinin eğimi pozitif olur ve bu durum net bir çekici kuvvete karşılık gelir. Atomlar birbirlerine çok yakın iken, eğim negatif ve net itici kuvvet gösterirler. Denge uzaklığında, çekici ve itici kuvvetler tamamen dengelenir ve potansiyel enerji bir minumum değere sahip olur ve eğrinin eğimi sıfır olur.
Moleküllerde bağlanma mekânizmasının tam olarak açıklanması oldukça karmaşık bir problemdir. Çünkü birçok parçacığın karşılıklı etkileşmesini içerir. Bu bölümde birkaç basitleştirilmiş model tartışılacaktır. Moleküller bağlar, bağ kuvvetine göre büyükten küçüğe: iyonik bağ, kovalent bağ, hidrojen bağı ve van der waals bağı olarak sıralanır.
Moleküller Bağlar
İyonik Bağlanma
Bir atom, diğer atoma bir veya daha fazla dış elektronunu vererek birleştiğinde kurulan bağa iyonik bağ denir. İyonik bağlar esas itibarıyla, zıt yüklü iyonlar arasındaki çekici Coulomb etkileşmesinden dolayı meydana gelir.
İyonik olarak bağlanmış molekül için alışılmış bir örnek sofra tuzu, NaCl(sodyum klorür)dür. Sodyum, 1s22s22p63s elektronik yerleşime (konfigürasyona) sahiptir ve 3s değerlik elektronunu verip Na+ iyonu oluşturmak üzere kolayca iyonlaşır. Sodyum atomundan Na+ iyonu oluşturmak için gerekli olan enerji 5,1 eV’dir. Klorun elektron düzeni de 1s22s22p5 şeklindedir ve dolu dış tabakalı (kabuklu) yapıya sahip argona benzemek için bir elektrona ihtiyacı vardır. Dış kabuğu dolu yapılar enerjik olarak daha uygun olduğundan, Cl– iyonu yüksüz (nötr) C1 atomundan daha kararlıdır. Bir atomun, bir elektron aldığında saldığı enerji elektron ilgisi olarak adlandırılır. Klor için elektron ilgisi 3,6 eV’dir. Bundan dolayı, yüksüz Na ve C1 atomlarını sonsuz uzakta Na+ ve C– iyonlarına dönüştürmek için 5,1 – 3,6 = 1,5 eV enerji verilmelidir.
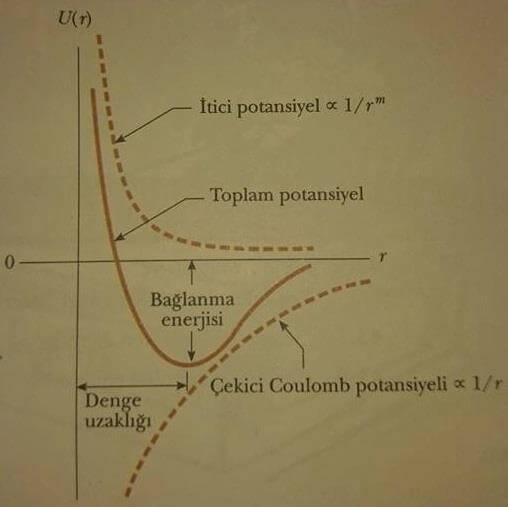
NaCl için, toplam enerjinin çekirdekler arası uzaklığa göre çizimi Şekil 2 de gösterilmiştir. Molekülün toplam enerjisinin, yaklaşık 0,24 nm lik denge mesafesinde (atomlar arası mesafe) -4,2 eV luk minimum değerine sahip olduğuna dikkat edilmelidir. NaCl molekülünü yüksüz sodyum ve klor atomlarına ayırmak için gerekli olan 4,2 eV a eşit enerjiye ayrışma enerjisi denir.
İki iyon 0,24 nm’den daha yakına getirildiğinde, dış tabakalardaki elektronlar üst üste gelmeye başlar ve dış tabakalar arasında itme meydana gelir. Bu itmenin kaynağının bir kısmı elektrostatik ve bir kısmı da dışarılama ilkesi sonucudur. Tüm elektronlar dışarılama ilkesine uymak zorunda olduğundan, üst üste gelen tabakalardaki elektronların bir kısmı yüksek enerji seviyelerine zorlanır ve onlar arasında itici etkileşme oluşuncaya kadar, sistemin enerjisi yükselir.
Kovalent Bağlanma
İki atom arasındaki kovalent bağ, bir molekül oluşturmak üzere bir atom veya her iki atomun elektronlarının ortaklaşa kullanılması olarak düşünülebilir.
H2, F2 ve CO gibi birçok iki atomlu molekül, kararlılıklarını kovalent bağlara borçludur. H2 molekülü durumunda iki elektron çekirdekler tarafından eşit olarak paylaşılır ve moleküller yörüngemsi (orbital) olarak adlandırılan yapı kurulur. İki çekirdek arasındaki bölgede elektron yoğunluğu yüksektir ve elektronlar “tutkal” gibi davranarak çekirdekleri bir arada tutarlar.

İki hidrojen atomunun s yörüngemsilerinden moleküller yörüngemsinin oluşumu Şekil 3 de görülüyor. Dışarılama ilkesi nedeniyle, taban durumundaki H2’nin iki elektronu zıt (anti) paralel spinlere sahip olmak zorundadır. Üçüncü bir H atomu H2 molekülü yakınına getirilirse, dışarılama ilkesi nedeniyle üçüncü elektron daha yüksek enerjili kuantum durumunu işgal etmelidir. Ancak bu enerjik olarak uygun olmayan bir durumdur. Bu nedenle, H3 molekülü kararlı değildir ve oluşmaz.
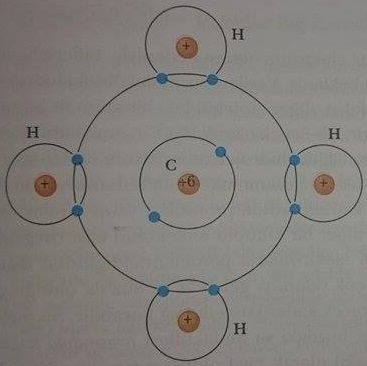
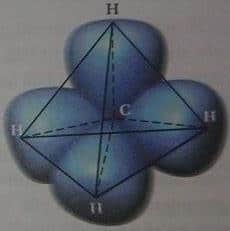
H20, C02 ve CH4 gibi H2 den daha karmaşık, kararlı moleküller de kovalent bağlarla oluşur. Metan’ı (CH4), ele alalım; tipik bir organik moleküldür ve elektron paylaşım biçimi şematik olarak Şekil 4a da görülüyor. Bu durumda, karbon atomu ile herbir hidrojen atomu arasında dört G-H kovalent bağ kurulur. Dört kovalent bağın uzaysal elektron dağılımı Şekil 4b de görülüyor. Dört hidrojen çekirdeği düzgün dörtyüzlünün köşelerinde ve karbon çekirdeği merkezindedir.
Kovalent moleküllerin en dış moleküller yörüngemsileri (orbitalleri) dolu olduğundan, böyle moleküller arası etkileşmeler oldukça zayıftır. Gerçekte, çok sayıda kovalent molekül, katıdan ziyade gaz veya sıvı şeklindedir.
Van der Waals Bağlanma
İki molekül belirli bir uzaklıkta bulunuyorsa, birbirlerini zayıf elektrostatik kuvvetler ile çekerler bunlara vann der Waals kuvvetleri denir. Aynı şekilde, iyonik veya kovalent bağlar oluşturmamış atomlar da van der Waals kuvvetleri ile çekerler. Bu nedenle, ısısal uyarılmaların ihmal edilebildiği yeterince düşük sıcaklıklarda maddeler önce sıvı sonra da katılaşmak üzere yoğunlaşırlar (Özel olarak helyum, atmosfer basıncı altında katılaşmaz).
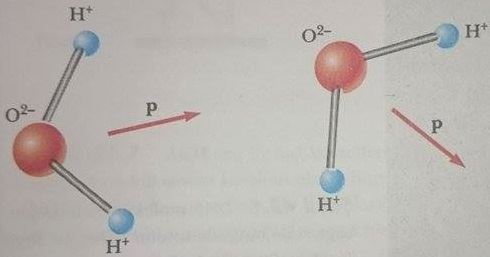
Üç tür van der Waals kuvveti vardır. Birinci tipe dipol-dipol kuvveti denir ve sürekli elektrik dipole sahip iki molekül arasındaki etkileşmedir. Örneğin, H20 gibi kutuplu (polar) moleküller sürekli elektrik dipol momentlere sahiptir ve diğer kutuplu molekülleri çekerler (Şek. 5). Gerçekte, bir molekül diğer molekül tarafından oluşturulan elektrik alan ile etkileşir.
İkinci tip van der Waals kuvveti dipol-indüklenmiş dipol kuvvetidir. Öyleki, sürekli elektrik dipol momente sahip kutuplu molekül, kutuplu olmayan molekülde bir dipol moment indükler.
Üçüncü tip van der Waals kuvvetine dağınım (dispersiyon) kuvveti denir. İki tane kutuplu olmayan molekül arasında meydana gelen dağınım kuvveti çekici bir kuvvettir. Bu durumda, kutuplu olmayan moleküllerin dipol momentlerinin ortalaması sıfır olmasına rağmen, yük dalgalanmaları nedeniyle dipol momentlerinin karelerinin ortalaması sıfırdan farklıdır. Bu nedenle, birbirinin yakınında olan iki kutuplu olmayan molekül, çekici bir kuvvet (van der Waals kuvveti) oluşturacak şekilde birbiriyle etkileşme eğilimde olur.
Hidrojen Bağı
Hidrojen atomunun sadece bir tane elektronu olması nedeniyle, sadece bir diğer atom ile kovalent bağ kurması beklenir. Verilen bir molekülde ki hidrojen atomu ikinci tip bir bağ kurabilir, fakat, diğer molekülde ki bir atom ile bağlanma bir hidrojen bağı üzerinden olur. Bir örnek olarak H20 su molekülünü ele alalım. Bu molekülde ki iki kovalent bağda, hidrojen atomlarının elektronları, hidrojen atomları yakınından çok oksijen atomu yakınında bulunurlar. Bu da esas olarak hidrojen atomlarının konumlarında protonları yalın bırakır. Bu perdelenmemiş artı yük (pozitif), diğer bir kutuplu molekülün eksi (negatif) ucu tarafından çekilebilir. Proton elektronlarla perdelenmediğinden diğer molekülün negatif ucu protonun çok yakınına gelebilir ve buzda olduğu gibi, katı kristal yapı oluşturmaya yetecek kadar kuvvetli bağ kurabilir. Su molekülündeki bağlar kovalenttir, fakat buzdaki su molekülleri arasındaki bağlar hidrojen bağıdır. Hidrojen bağı bağıl olarak zayıf olduğundan, buz 0°C gibi düşük sıcaklıkta erir.
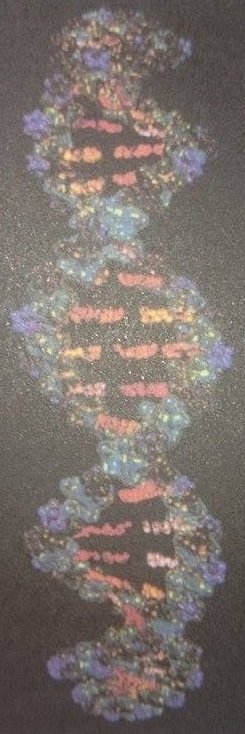
Hidrojen bağı 0,1 eV civarında bağlanma enerjisine sahiptir. Hidrojen bağı zayıf olmasına rağmen, çok büyük biyolojik moleküllerin ve polimerlerin bağlanmasının temelini oluşturur. Örneğin, çift helis şeklinde bir yapıya sahip olan meşhur DNA molekülü durumunda (Şek. 6) iki atom arasında, protonun paylaşımı ile kurulan hidrojen bağı, helis kıvrımları arasından zincir oluşturur.
Moleküller bağlar ve çeşitlerini sizlere konu anlatımı yaptım. Diğer yazımızda görüşmek üzere

