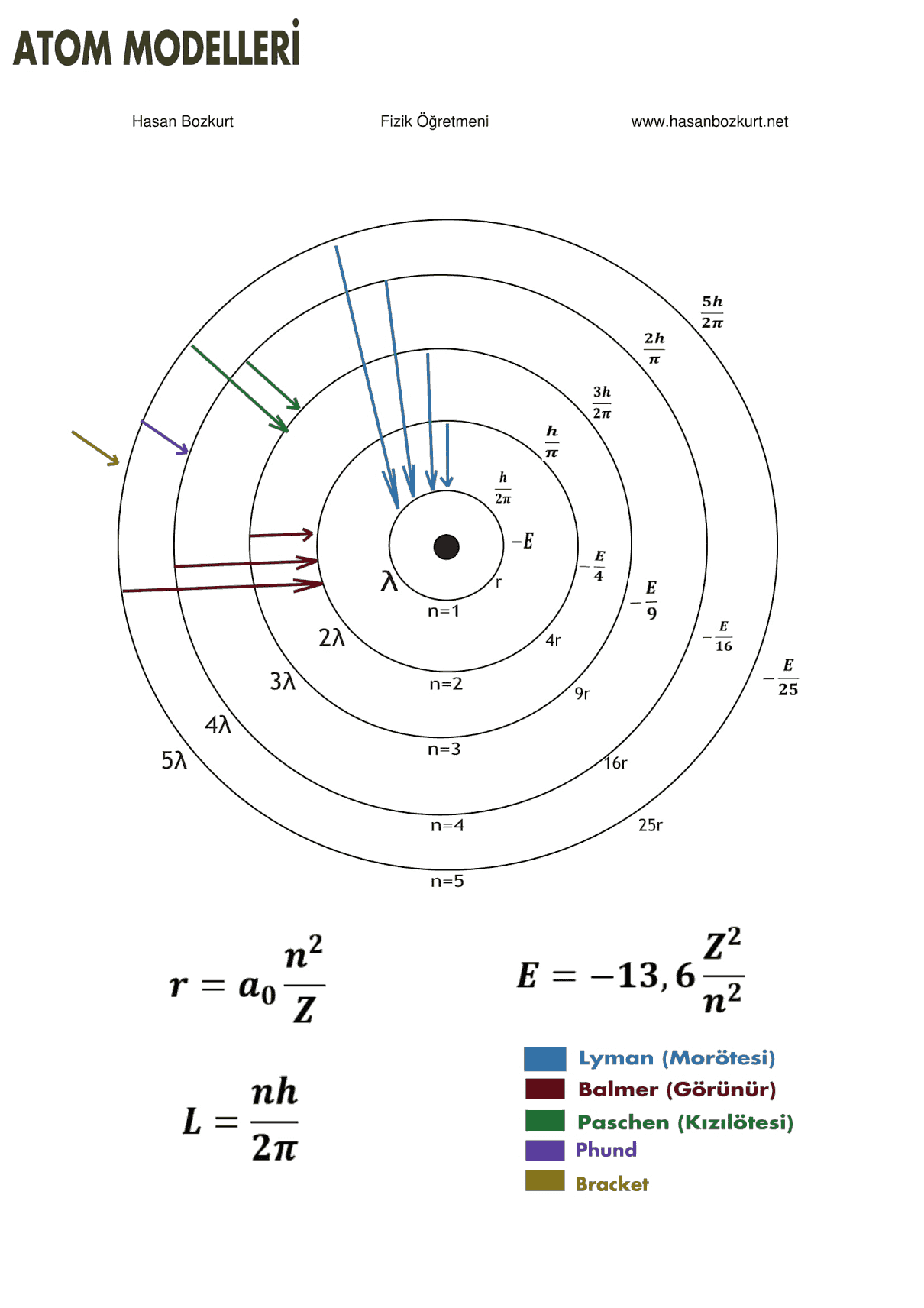
Bu yazıda maddenin yapı taşlarını ele alacağız. 1 kg’lık katı bir altın küpün bir kenarı 3,73 cm’dir. Bu küp, hiç boşluk olmayacak şekilde altın atomlarının yan yana dizilmesi ile mi oluşmaktadır? Bu küp ikiye bölünürse, küpün her bir parçası hala katı altınla aynı kimyasal özelliklere sahiptir. Bu parçalar kesile kesile sonsuz küçük olacak şekilde parçalara bölünürse ne olur? Bu küçük parçalar yine altının özelliklerini taşır mı? Bu gibi sorular eski Yunan Filozoflarının zamanına kadar uzanır. Bu filozoflardan ikisi Leucippus ve öğrencisi Democritus bu şekilde parçalanmanın sonsuza kadar yapılabileceğini kabul etmemişlerdi. Bu işlemde bir parçanın artık bölünemeyeceğini, bu sürecin mutlaka sonlanacağı hakkında fikir yürütmüşlerdir. Eski Yunanca’da atomun anlamı “bölünemez” demektir. İngilizce’ye atom kelimesi buradan gelmektedir.
Maddelerin yapısı hakkında bildiklerinizi kısaca özetleyelim. Bütün maddeler atomlardan, atomlar da merkezinde çekirdek bulunan ve bu çekirdek etrafında dolanan elektronlardan meydana gelmiştir. 1911’de çekirdeğin keşfinden sonra, şu soru sorulmuştur. Acaba çekirdek bir tek parçacık mıdır? Çekirdeğin tam bileşimi bu gün bile henüz tam olarak bilinmemektedir. Fakat 1930’ların başlarında ileri sürülen bir model, çekirdeğin davranışının anlaşılmasına yardımcı olmuştur. Bilim adamlarınca, çekirdeğin iki temel parçacıktan proton ve nötronlardan oluştuğu belirlenmiştir. Proton, pozitif elektrik yükü taşımakta ve her element çekirdekteki proton sayısı ile ayırt edilmektedir. Bu sayıya elementin atom numarası denir.
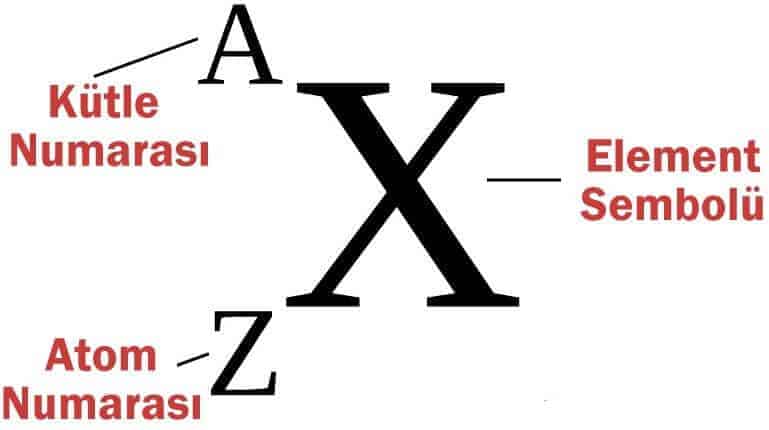
Örneğin; hidrojen atomunun çekirdeğinde bir proton (bu yüzden hidrojenin atom numarası 1’dir) bulunmaktadır. Helyum atomunun çekirdeği ise iki proton (atom numarası 2) içerir. Uranyum atomunun çekirdeğinde 92 proton bulunmaktadır (atom numarası 92). Atom numarasına ilaveten, atomları, çekirdekteki protonların ve nötronların sayısının toplamı şeklinde ifade edilen kütle numarası da karakterize eder. Daha sonra göreceğiz ki, bir elementin numarası hiçbir zaman değişmezken (proton sayısı değişmediğinden) kütle numarası değişebilir (nötron sayısı değişebileceğinden). Aynı elementin atomları, iki veya daha fazla kütle numaralarına sahip olabilirler ve bunlar birbirlerinin izotopları’dır.
Nötronların varlığı 1932 yılında tam olarak kanıtlanmıştır. Nötronların yükü yoktur, kütlesi de bir protonun kütlesine yaklaşık eşittir. Nötronların en önemli özelliği, çekirdeği bir “tutkal” gibi bir arada tutmasıdır. Nötronlar çekirdekte bulunmasalardı, pozitif yüklü protonlar arasında oluşacak itici kuvvet, çekirdeğin parçalanıp yok olmasına neden olacaktı.
Daha önce bahsettiğimiz parçalanma nereye kadar gider? Proton, nötron ve diğer bazı parçacıkların, quark denilen parçacıkların altı farklı türünün bileşiminden oluştuğu bugün bilinmektedir. Bunlara yukarı, aşağı, acayip, sihirli dip ve tepe quark isimleri verilmektedir. Yukarı, sihirli ve tepe quarklardan her biri proton yükünün +2/3’ü kadar, aşağı, acayip ve dip quarklar da protonun -1/3’ü kadar yük taşırlar. Proton, iki yukarı, bir aşağı quarktan oluşur. Böylelikle protonun yükü kolayca doğrulabilir. Benzer şekilde nötron, iki aşağı ve bir yukarı quarktan oluştuğundan net yükün sıfır olduğu görülebilir.
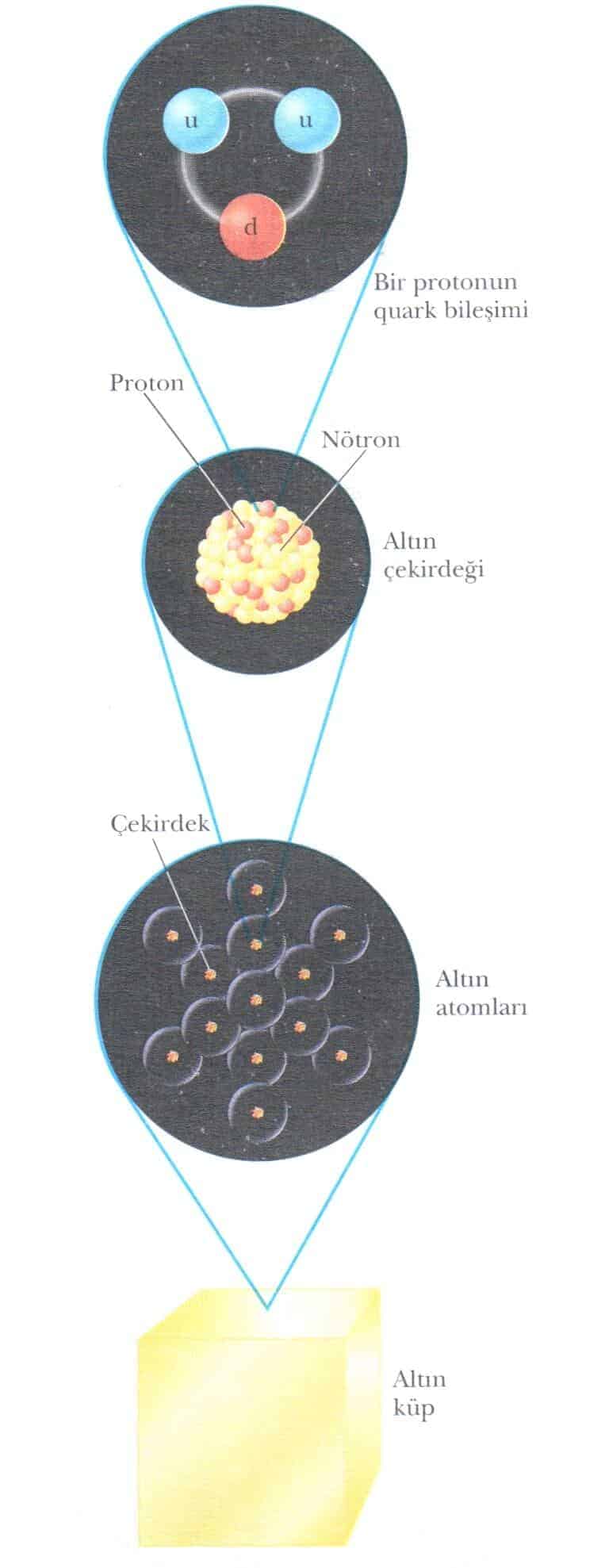
Sıradan maddeler atomlardan oluşmuştur ve her atomun merkezinde proton ve nötron içeren çekirdek bulunur. Proton ve nötronlar quarklardan meydana gelmiştir. Bir protonu oluşturan quarklar gösterilmiştir.
Kaynak: Serway Fizik Kitabı