Her noktasında aynı ve değişmeyen bir kimyasal bileşime sahip olan maddeye saf madde adı verilir. Su, azot, helyum, karbon dioksit birer saf maddedir.
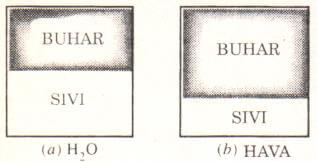
Saf maddenin sadece bir tek kimyasal element veya bileşimden oluşması gerekmez. Değişik kimyasal elementlerden veya bileşimlerden oluşan bir karışım da, düzgün dağılır (homojen) olduğu sürece saf madde tanım2ına uyar. Örnek olarak hava değişik gazlardan oluşan bir karışımdır, kimyasal bileşimi her noktada aynı ve değişmez olduğu için saf maddedir (Şekil 2-1). Buna karşılık su ve yağ karışımı saf bir madde sayılamaz, çünkü böyle bir karışımda, yağ suda çözülmeyip üstte toplandığından, kimyasal olarak birbirine benzemeyen iki ayrı bölge oluşur.

Saf bir maddenin iki veya daha çok fazının bir arada bulunduğu bir karışım da, fazların kimyasal bileşiminde bir farklılık olmadığı sürece saf madde kapsamına girer (Şekil 2-2). Örneğin sıvı su ve buz karışımı saf bir maddedir, çünkü her iki fazın da kimyasal bileşimi aynıdır. Buna karşılık sıvı hava ile gaz havanın oluşturduğu karışım saf bir madde değildir, çünkü sıvı havanın kimyasal bileşimi gaz havanınkinden farklıdır. Bunun nedeni, havayı oluşturan gazların değişik yoğuşma sıcaklıklarına sahip olmalarıdır.
Saf Maddenin Fazları
Oda sıcaklığında ve basıncında bakır katıdır, cıva sıvıdır, azot ise gazdır. Değişik koşullarda her biri farklı bir fazda bulunabilir. Temelde katı, sıvı ve gaz olmak üzere üç faz vardır. Fakat her temel faz içinde farklı molekül düzenine sahip başka fazlar da olabilir. Örnek olarak karbon, katı fazı içinde grafit veya elmas fazlarında bulunabilir. Helyumun iki sıvı fazı, demirin üç katı fazı vardır. Yüksek basınçlarda buz yedi değişik fazda bulunabilir. Faz, fiziksel olarak belirgin sınırların içinde her noktada aynı olan belirli bir molekül düzenini simgeler. Buzlu su, suyun iki fazını açıklayan güzel bir örnektir.
Termodinamik’de fazları veya faz değişimlerini incelerken, fazların molekül düzenlerini ve ayrı ayrı davranışlarını bilmek gerekmez. Fakat fazlar ve faz değişimleriyle ilişkili olarak molekül düzeyinde bazı olguları anlamakta yarar vardır. Aşağıda bu bilgilere kısaca yer verilmiştir.
Moleküller arasındaki en kuvvetli bağların katılar da, en zayıf bağların da gazlarda olduğu sık sık vurgulanır. Bunun bir nedeni katılar da moleküllerin daha sık kümelenmeleri, gazlarda ise aralarında büyük boşlukların olmasıdır.
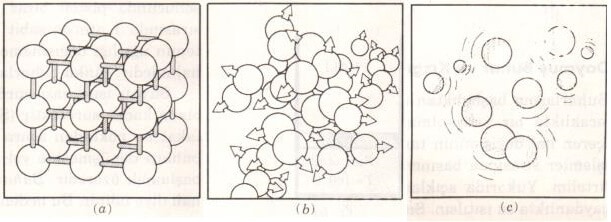
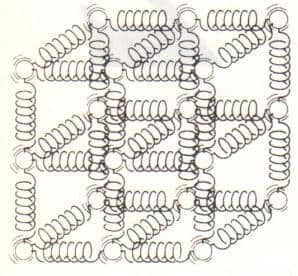
Katı fazında moleküller latis adı verilen ve kendini tekrarlayan üç boyutlu bir düzende yer alırlar (Şekil 2-3). Katı cisim içindeki moleküller birbirlerine yakın olduklarından, onları birbirine çeken kuvvetler güçlüdür ve bu nedenle moleküller yerlerinde sabit kalırlar (Şekil 2-4). Molekülleri birbirine çeken kuvvetler moleküller arasındaki uzaklık sıfıra yaklaşınca itici kuvvetlere dönüşürler, bu nedenle moleküllerin birbiri üzerine yığılmaları söz konusu olmaz. Katı bir cisimdeki moleküller her ne kadar yerlerinde kalsalar da, bulundukları yerde sürekli olarak titreşirler. Bu titreşim sırasında moleküllerin hızları sıcaklığa bağlıdır.

Sıcaklık yeterince arttığı zaman moleküllerin hızları ve dolayısıyla momentumları molekülleri bir arada tutan kuvvetlere üstünlük sağlar ve molekül kümeleri ayrılmaya başlar (Şekil 2-5). Bu nokta, erimenin başladığı andır.
Sıvı fazında moleküllerin arasındaki mesafe katı fazına oranla çok farklı değildir, fakat moleküller artık yerlerinde sabit kalmak yerine kümeler halinde birbirlerinin üzerinden kayarlar. Bununla birlikte, her küme içindeki yapısal düzen bozulmaz ve moleküller birbirlerine göre yerlerini korurlar. Moleküller arasındaki mesafe madde katıdan sıvıya dönüşürken biraz artar, bunun tersi çok az madde için geçerlidir, su bu tür maddelerden biridir.
Gaz fazında moleküller birbirlerinden iyice uzaklaşmışlardır ve yapısal bir düzenden söz edilemez. Gaz molekülleri rastgele bir hareket içindedir ve sürekli olarak birbirleriyle ve içinde bulundukları kabın duvarlarıyla çarpışırlar. Özellikle düşük yoğunluklarda, moleküller arasındaki kuvvetler çok küçüktür ve moleküller arasındaki çarpışmalar tek etkileşim yoludur. Gaz fazındaki moleküllerin enerji düzeyleri sıvı ve katı fazındakilere oranla oldukça yüksektir. Bu nedenle bir gaz yoğuşurken veya donarken çevreye büyük miktarlarda enerji vermek durumundadır.