Lityum 1A grubunda bulunan en hafif metaldir, bunun yanında 1A grubunda bulunan metallere alkali metal denir. Lityum, reaksiyona girdiği suyun yüzeyinde kolayca yüzer, eriyik halde bulunan lityumun yoğunluğu suyun yarısı kadardır. Lityum suyla reaksiyona girdiğinde, hidrojen gazı açığa çıkar. Lityumu makasla kesilebilecek kadar yumuşaktır. Yumuşak, beyaz ve parlak olan alkali metal olan lityum, alaşımları ve bileşiklerinin çoğu endüstriyel ölçekte üretilmektedir. Lityum oksijen ile hemen tepkimeye girer ve lityum oksit (Li2O) oluşturur.
Lityumun Bulunuşu ve Üretimi
Lityum 1817’de İsveçli kimyager tarafından maden yataklarında keşfedildi; deniz suyu içindeki konsantrasyonu milyonda 0.1 ppm’dir. Lityum ayrıca, spodümen (LiAlSi2O6) ve lepidolit (değişken yapıdaki) gibi pegmatit cevherlerinde veya Li2O ile yüzde 4 ila 8,5 arasında değişen ambargonit (LiAlFP04) cevherlerinde bulunur. Dünya kabuğunun yüzde 0.002’sini oluşturur. 1990’lı yıllara kadar lityum kimyasal ve metal piyasası Amerikan maden yataklarından elde ediliyordu. Ancak 21. yüzyılın başlarında üretimin çoğu ABD dışındaki kaynaklardan elde edilmeye başlandı. Başlıca ülkeler; Avustralya, Şili ve Portekiz.
Ülkere Göre Lityum Üretimi
| Ülkeler | Maden Üretimi (Ton) |
| Şili | 8,200 |
| Avustralya | 5,500 |
| Arjantin | 2,900 |
| Çin | 2,820 |
| Rusya | 2,200 |
| Kanada | 707 |
| Zimbabve | 600 |
| Portekiz | 320 |
| Brezilya | 242 |
| Dünya Geneli | 23,500 |
| Kaynak: ABD İçişleri Bakanlığı, Mineral Commodity Summaries 2007 | |
Lityumun Üretimi
Lityum, kaynamış bir lityum potasyum klorür karışımının elektrolizi ile üretilir. Karışımın erime noktası (400–420° C), saf lityum klorür (610° C), elektrolizin daha düşük sıcaklıkta gerçekleşmesini sağlar. Lityum klorürün ayrışmasının gerçekleştiği voltaj, potasyum klorürün voltajından daha düşük olduğundan, lityum yüzde 97’den daha büyük bir saflık seviyesinde ayrıştırılır. Katotlar çelikten, anotlar ise grafitten yapılır. Katotta oluşan saf lityum elektrolitin yüzeyinde birleşir. Katot üzerinde ince bir elektrolit film bulunur. Hava ile reaksiyondan korunan bir erimiş bölge oluşturur.
Lityumun Fiziksel ve Kimyasal Özellikleri
1932 yılında İngiliz fizikçi John Cockcroft ve İrlandalı fizikçi Ernest Walton’un öncü çalışmalarında yapay olarak hızlandırılmış atomik parçacıklar tarafından çekirdeklerin aktarılması çalışmasında lityum kullanıldı. Bir protonu emen her lityum çekirdeği iki helyum çekirdeği oluşturur. Lityum-6’nın yavaş nötronlarla bombardıman edilmesi helyum ve trityum (3H) elde edilir. Bu reaksiyon, trityum üretiminin ana kaynağıdır. Bu şekilde üretilen trityum, biyolojik araştırmalar için radyoaktif bir hidrojen izotopunun sağlanması gibi diğer kullanımların yanı sıra, hidrojen bombalarının üretiminde de kullanılır.
Lityum, nükleer reaktörler için bir ısı taşıcıyı sıvısı olarakta kullanılmaktadır. Çoğunlukla nükleer güç ile çalışan uzay araçlarında kullanılmaktadır. En yaygın kararlı izotop olan lityum-7 izotopu düşük nötron emme özelliğine sahiptir. Bu nedenle, yaklaşık 800 ° C’nin (1.500 ° C’nin üzerindeki sıcaklıklara sahip nükleer reaktörler için ısı taşıyıcı olarak kullanılır. İzotopları, lityum-8 (yarı ömür 0.855 saniye) ve lityum-9 (yarı ömür 0.17 saniye) nükleer bombardıman sonucu üretilmiştir.
- Sembol: Li
- Latince adı: Lityum
- Madde cinsi: Basit kimyasal element
- Kaşif: A. Arfvedson
- Bulunuş tarihi: 1817
- Atom numarası: 3
- Atom ağırlığı: 6.941
- Grup: 1A
- Grup: Alkali metal
- Periyot sayısı: 2
- Yoğunluğu: 0.535×103 (Kg/m3)
- Ses Hızı: 6000 (m/s)
- Normal koşullar altındaki durumu: katı
- Erime noktası: 453.69° K (Kelvin)
- Kaynama noktası: 1615.15° K (Kelvin)
- Elektrik iletkenlik: İletken tip
- Manyetik geçirgenlik: Paramanyetik
- Renk: Gümüş
Lityum emisyon spektrumu
- Elektron dizilimi: 1s22s1
- Atom yarıçapı: 167×10-12 (Metre)
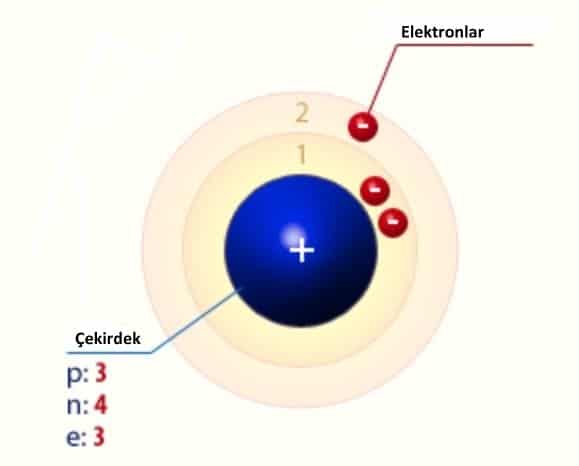
- Proton sayısı p: 3
- Nötron sayısı n: 4
- Elektron sayısı e: 3
- Kütle numarası A: 7
Lityumun Atomik Yapısı
Lityumun radyoaktif özellikleri:
Doğal radyoaktivite göstermeyen Lityum, 6 numaralı kütleye (yüzde 92,5) ve 7’ye (yüzde 7,5) sahip iki izotoptan oluşur. Lityum-7 / lityum-6 oranı 12 ila 13 arasındadır.
- Kararlılık: Kararlı element
- Değerlik: 1
Lityum yaygınlığı:
- Evren: % 6×10-7 oranında lityumdan oluşmaktadır
- Güneş: % 6×10-9 oranında lityumdan oluşur.
- Okyanuslar: 0.000018% lityumdan oluşmaktadır.
- İnsan vücudu: % 3×10-6 oranında lityumdan oluşur
Lityumun Biyolojik Özellikleri
Bitkilerde yaygın olarak görülen lityum oluşumu, hayvanlarda geniş ve düşük seviyeli bir lityum dağılımı görülür. Lityum tuzları vücuda alındığında karmaşık etkilere sahiptir. Yüksek düzeyde ölümcül olabilmesine rağmen, bunlar toksik değildir. Gut tedavisinde (başarısız) ve depresyonun önlenmesinde (başarılı bir şekilde) ve tedavi edilmesinde lityum içeren ilaçlar 19. yy sonlarına kadar kullanılmıştır. Ancak 20. yüzyılın başlarında tıbbi uyuşmazlığa düştü.