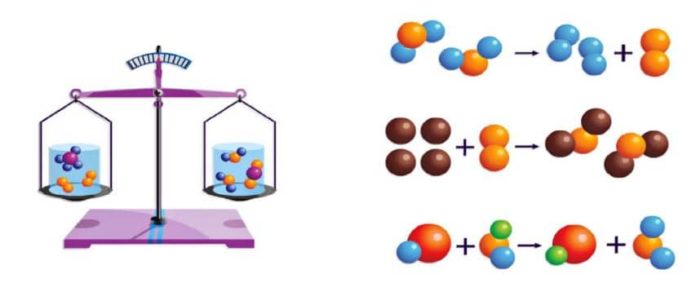
Kütle korunumu kanununda, kimyasal reaksiyonlarda, atom sayısı korunur, bunun yanında tüm atomların kütlesi de korunmalıdır. Bu durumda, herhangi bir kimyasal reaksiyonun ürünleri başlangıç materyalleri ile aynı kütleye sahip olmalıdır. Atomların ve moleküllerin varlığını kanıtladıktan sonra, atom-moleküler teorinin en önemli keşfi, 1748’de büyük Rus bilim adamı Michael Vasilievich Lomonosov (1711-1765) tarafından felsefi bir kavram olarak formüle edilen kütle Koruma Yasası haline geldi ve 1756’da deneysel olarak kendileri tarafından doğrulandı. 1789’da Fransız kimyager Antoine Lavoisier tarafından bağımsız olarak onaylandı.
Lomonosov’dan önce maddelerin yakılması üzerine yapılan deneyler, reaksiyon sürecindeki maddelerin kütlesinin korunmadığını ortaya çıkardı. Havada ısıtıldığında civa daha fazla metal kütlesi olan kırmızı bir ölçek haline geldi. Ağaç yanarken oluşan kül kütlesi aksine her zaman kullanılan ağacın kütlesinden daha azdır.
Lomonosov, metalin yanmasının bir ekleme reaksiyonu olduğunu ve metal kütlesinin artmasının havanın bir kısmının eklenmesiyle ortaya çıktığını gösteren basit bir deney yaptı. Metalleri lehimli kapalı bir cam kapta yaktı ve kimyasal reaksiyon meydana gelmiş olmasına rağmen cam kabın kütlesinin değişmediğini keşfetti. Cam kap açıldıktan sonra, hava içine girdi ve cam kabın kütlesi arttı. Bu nedenle, reaksiyondaki tüm maddelerin kütlesinin düzgün bir şekilde ölçülmesiyle, kimyasal reaksiyondaki maddelerin kütlesinin korunduğu ortaya çıktı.
Bazı tepkime örnekleri:
- 2H2O → H2 + O2
- ЕAg + S → Ag2S
- 2Ag + S = Ag2S
Kütlenin korunumu kanunu atomik moleküler teorisi için büyük bir fark yarattı. Atomların bölünmez olduğunu ve kimyasal reaksiyonlarda değişmediğini doğruladı. Reaksiyondaki moleküller atomlarla değiştirilir, ancak her türdeki atomların toplam sayısı değişmez ve bu nedenle reaksiyon sürecinde toplam madde kütlesi korunur.
Kütlenin korunumu kanunu, yalıtılmış bir sistemin enerjisinin sabit olduğunu belirten, enerjinin korunumu yasasıdır. Enerji, çeşitli madde türlerinin hareketinin ve etkileşiminin bir ölçüsüdür. Yalıtılmış bir sistemdeki herhangi bir süreçte, enerji üretilmez ve yok edilmez, sadece bir formdan diğerine geçebilir.
Enerjinin biçimlerinden biri, Einstein enerji formülü , kütle ile ilgili olan serbest enerjidir.
C ışığın hızıdır (c = 3.108 m/s). Bu ilişki, kütlenin enerjiye dönüşebileceğini ve tersini gösterebileceğini göstermektedir. Bu, tüm nükleer reaksiyonlarda tam olarak ne olduğu ve bu nedenle nükleer süreçlerde kitlesel korunma yasası ihlal edilmektedir. Ancak, enerjinin korunum yasası, bu durumda, serbest enerjisini hesaba katarsak, adil kalır. Kimyasal reaksiyonlarda, enerjinin salınması veya emilmesi ile oluşan kütle değişimi çok azdır. Bir kimyasal reaksiyonun tipik termal etkisi, büyüklük sırasına göre 100 kJ / mol’dür. Bunun kütleyi nasıl değiştirdiğini hesaplayalım:
m = ∆E / 22 = 105 / (3.108) 2 ~ 10-12 kg / mol = 10-9 g / mol