Merhaba arkadaşlar bugün sizlere katıların bant teorisi ve katıların bant yapısını anlatacağım. Şayet iki özdeş atom birbirinden çok büyük uzaklıkta iseler etkileşmezler ve elektronik enerji seviyeleri yalıtılmış atomların ki gibi düşünülebilir. Farzedelim ki bu iki atom sodyumdur ve her biri 3s elektronuna sahip olup enerjileri kesin olarak bilinmektedir. İki sodyum atomu birbiri yakınına getirildiğinde, onların dış orbitalleri (yörüngeleri) üstüste gelmeye başlar. Bunlar arasındaki etkileşme yeterince kuvvetli olduğunda, Şekil 1a da görüldüğü gibi, iki farklı 3s seviyesi meydana gelir.
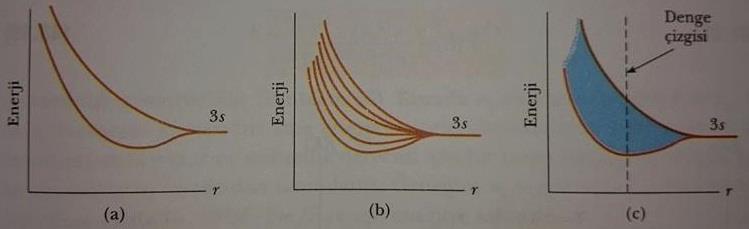
Çok sayıda atomlar katıyı oluşturmak üzere bir araya getirildiğinde de benzer olay meydana gelir. Atomlar birbirinin yakınına getirildikçe, birçok atomik enerji seviyesi yarılmaya başlar. Birbirine çok yakın altı atomun seviyelerindeki yarılmalar Şekil 1b de gösterilmiştir. Bu durumda, sistemin altı enerji seviyesi ve altı üst üste örtüşen (overlap) dalga fonksiyonu vardır. Belirli bir atomik enerji seviyesinden kaynaklanan bir enerji bandının genişliği katıdaki atomların sayısından bağımsız olduğundan, altı atomlu durumda enerji seviyeleri, iki atomlu durumdakinden daha yakın aralıklarla yerleşirler.
Bu tartışma çok sayıda atomlara (1023 atom/cm3 mertebesinde) genişlettirilmesi, Şekil 1c deki gibi enerji seviyelerinin sürekli bandı olarak kabul edilebilen çok sayıda seviye oldukça yakın aralıklı olur. Sodyum durumunda, izinli enerji seviyelerinin sürekli dağılımına 3s bandı olarak bakılır. Çünkü bu band bireysel sodyum atomlarının 3s seviyelerinden meydana gelmektedir.
Genel olarak, bir kristallik katı, farklı atomik enerji seviyelerinden ileri gelen çok sayıda izinli enerji bandlarına sahiptir. Şekil 2 de, sodyumun izinli enerji bandlarını gösteriyor. Elektronların, izinli bandlar arasında yasak enerji bandları denilen enerji aralıkları meydana getirdiğine dikkat edilmelidir.
Katıların Bant Teorisi Özet
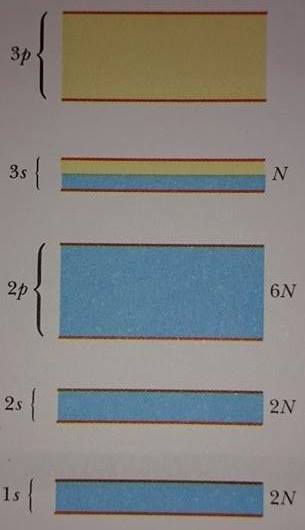
Şayet katı N atom içeriyorsa, her enerji bandının N tane enerji seviyesi vardır. Sodyum atomu durumunda, Şekil 2 de mavi bölgeler ile gösterilen, 1s, 2s ve 2p bandlarının her birisi doludur. Yörüngesel açısal momentumu l olan bir seviye 2(2l+ 1) elektron tutabilir. 2l+1 çarpanı yörüngesel açısal momentumun mümkün olan yönelmelerine ait iken, 2 çarpanı elektron spininin yönelmesinden ortaya çıkar. N atomlu bir sistem için her bir bandın alabileceği elektron sayısı 2(2l+1)N dir. Bundan dolayı, 1s ve 2s bandlarının her biri 2N elektron (l = 0) taşırken, 2p bandı 6N elektron (l = 1) taşır. Sodyum sadece bir tane 3s, değerlik elektronuna sahip olduğundan ve katıda toplam N tane elektron bulunduğundan, 3s bandı sadece N’tane elektron bulundurur ve ancak yarı doludur, Bu durum Şekil 2 de yarı-mavi ve yarı-altın olarak görülüyor. 3s bandının üstünde olan 3p bandı tamamen boştur. (Şekilde tümü altın renkli).


