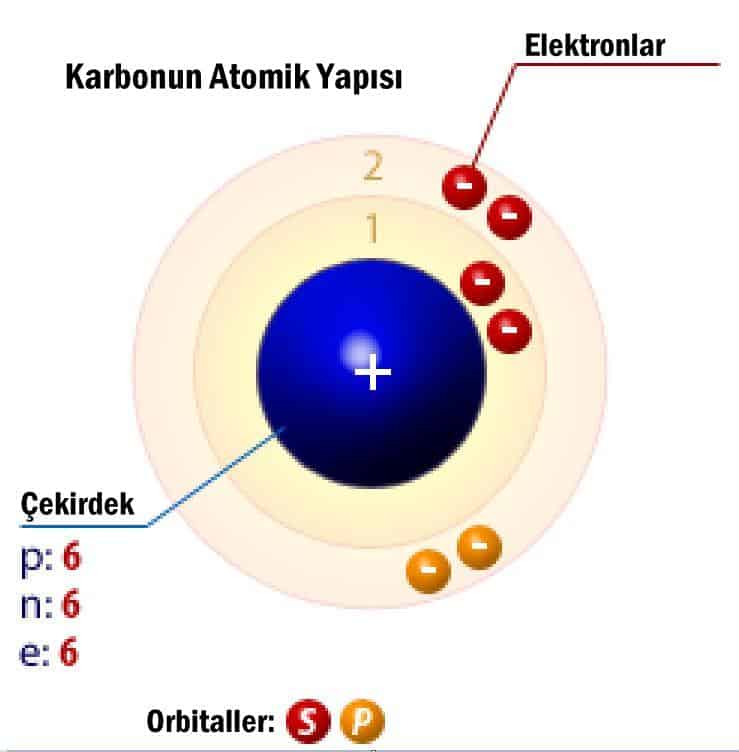
Karbon doğada bulunan en yaygın bir elementlerden biridir. Karbon sembolü C olup atom numarası (proton sayısı) 6 olan kimyasal bir elementidir. Periyodik tabloda 14. grupta bulunur. En yaygın karbon izotopunda 6 proton ve 6 nötron bulunur ve atomik kütlesi 12.0107 amu’dur. Karbon, iki adet stabil, doğal olarak oluşan izotoplara sahiptir: C-12 (% 98,89) ve C-13 (% 1,11). Doğada saf haliyle, grafit ve elmas şeklinde bulunur. Grafitin karbon bağları çok zayıf, elmasınkiler ise çok güçlüdür. Karbon atomunun allotroplarıdır. Bununla birlikte grafit ve elmasın oksijen ile tepkimesinde, aynı kimyasal reaksiyon gerçekleşir. Yandığında, karbon oksijene bağlanır ve karbondioksit oluşur.
Karbonun Özellikleri Nelerdir
Karbon, birçok nedenden dolayı önemli bir elementtir. Farklı formları arasında en yumuşak (grafit) ve insan tarafından bilinen en sert (elmas) bulunmaktadır. Ayrıca, diğer karbon atomları da dahil olmak üzere diğer küçük atomlarla bağlanma konusunda büyük bir afiniteye sahiptir ve çoklu bağlar oluşturma yeteneğine sahiptir. Bu özelliklerden dolayı, karbonun yaklaşık on milyon farklı bileşik oluşturduğu bilinmektedir. Karbon bileşikleri Dünyadaki tüm yaşamın temelini oluşturur ve karbon-azot döngüsü güneş ve diğer yıldızlar tarafından üretilen enerjinin bir kısmını sağlar.
| Genel Özellikleri | |
|---|---|
| Sembol, Atom Numarası | C, 6 |
| Grup | Ametal |
| Grup, Periyod, Blok | 14 (IVA), 2, p |
| Yoğunluk, Sertlik | 2267 kg/m3, 0.5 (grafit) 10.0 (elmas) |
| Görünüm | Siyah (grafit) Renksiz (elmas) |
| Atom Özellikleri | |
| Atom ağırlığı | 12.0107 amu |
| Atom yarıçapı | 70 (67) pm |
| Kovalent yarıçapı | 77 pm |
| Van der Waals yarıçapı | 170 pm |
| Elektron konfigürasyonu | [He]2s22p2 |
| e–s başına enerji miktarı | 2, 4 |
| Oksidasyon derecesi | 4, 2 (hafif asidik) |
| Kristal yapısı | Altıgen |
| Fiziksel Özellikleri | |
| Maddenin hali | Katı |
| Erime noktası | 3773 K (6332 °F) |
| Kaynama noktası | 5100 K (8721 °F) |
| Molar hacim | 5.29 ×10-6 m3/mol |
| Buharlaşma ısısı | 355.8 kJ/mol |
| Füzyon ısısı | N/A |
| Buhar basıncı | 0 Pa |
| Ses hızı | 18350 m/s |
| Diğer Özellikleri | |
| Elektronegativite | 2.55 (Pauling ölçeği) |
| Özgül ısı kapasitesi | 710 J/(kg*K) |
| Elektriksel iletkenlik | 0.061 × 106/m ohm |
| Termal iletkenlik | 129 W/(m*K) |
| 1. iyonlaşma potansiyeli | 1086.5 kJ/mol |
| 2. iyonlaşma potansiyeli | 2352.6 kJ/mol |
| 3. iyonlaşma potansiyeli | 4620.5 kJ/mol |
| 4. iyonlaşma potansiyeli | 6222.7 kJ/mol |
| 5. iyonlaşma potansiyeli | 37831 kJ/mol |
| 6. iyonlaşma potansiyeli | 47277.0 kJ/mol |
| SI sistemi kullanılmıştır. | |
Karbon Ne Zaman Bulundu
Karbon (Latince karbo anlamına gelen “kömür”) tarih öncesi keşfedildi. Elmasların uzun çağlar boyunca nadir ve güzel olduğu düşünülmektedir. Son bilinen karbon allotropu; fullerenler, 1980’lerde moleküler ışın deneylerinin yan ürünleri olarak keşfedildi.
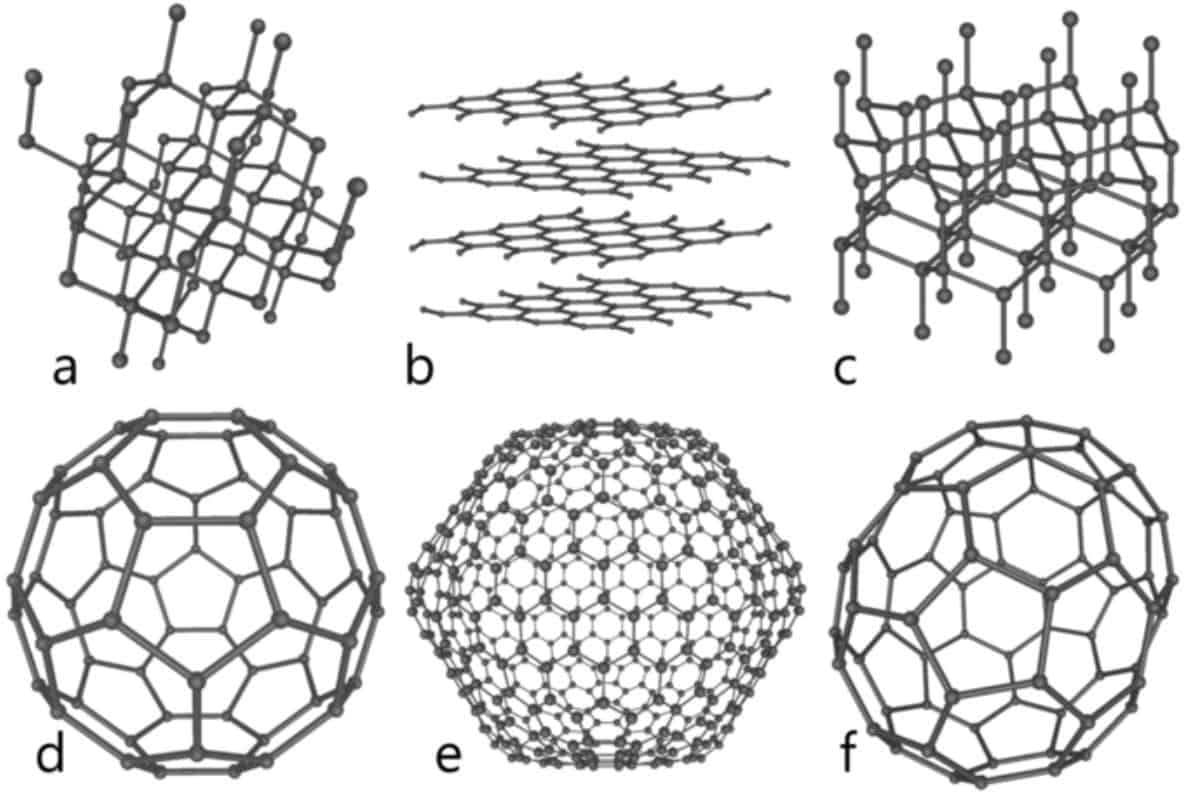
Karbonun Allotropları
Dört allotrop karbonun var olduğu bilinmektedir: amorf, grafit, elmas ve fullerenler. Amorf formunda, karbon esas olarak grafittir, ancak kristalin bir makro yapı içinde tutulmaz. Bunun yerine, kömür ve kurum gibi maddelerin ana bileşeni olan bir toz halinde bulunur. Amorf formunda, karbon esas olarak grafittir, ancak kristalin bir makro yapı içinde tutulmaz. Bunun yerine, kömür ve kurum gibi maddelerin ana bileşeni olan bir toz halinde bulunur.
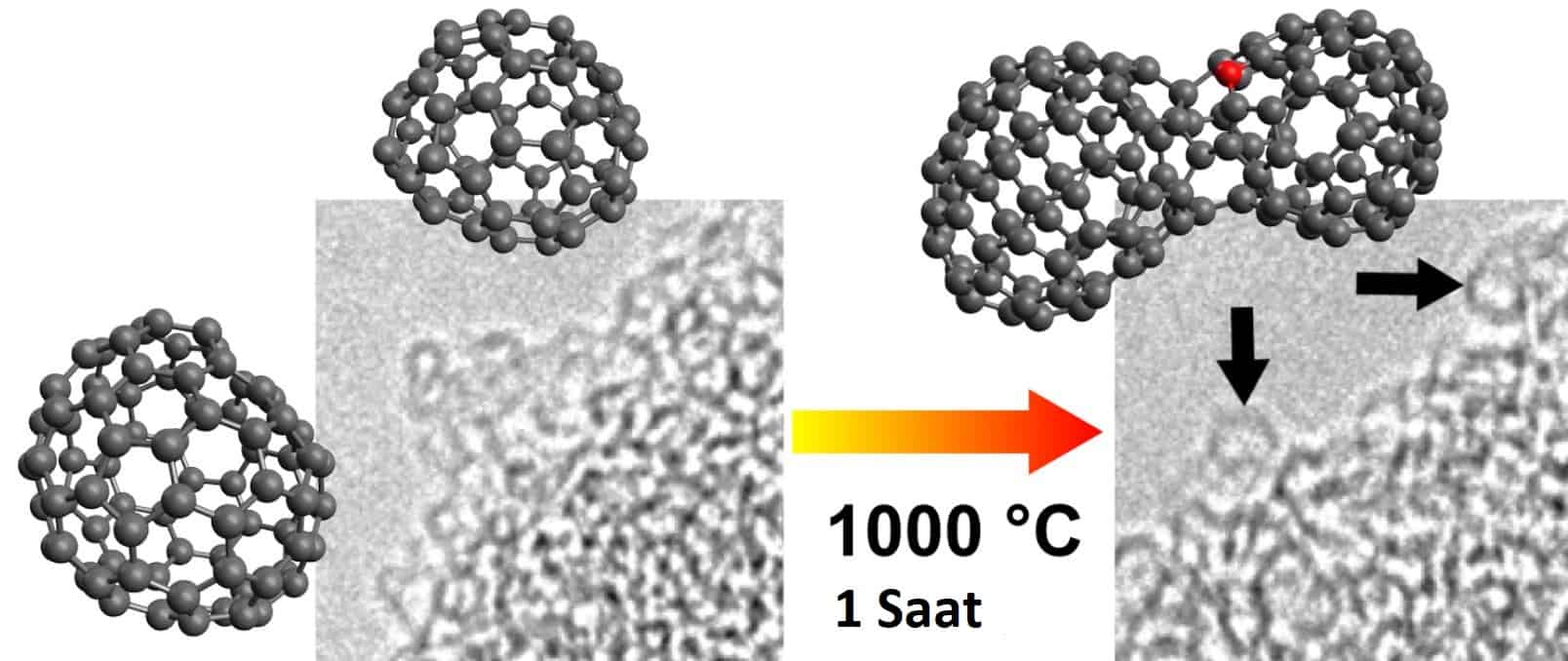
Normal basınçlarda karbon, her bir atomun diğer aromatik hidrokarbonlardaki gibi kaynaşmış altıgen halkalardan oluşan bir düzlemde diğerlerine üçüne bağlandığı grafit biçimini alır. Bilinen iki grafit formu, alfa (altıgen) ve beta (eşkenar dörtgen), ikisi de kristal yapıları dışında aynı fiziksel özelliklere sahiptir. Alfa formu mekanik işlemle beta formuna dönüştürülebilir ve beta formu 1000 °C’nin üzerine ısıtıldığında tekrar alfa formuna geri döner.
Pi-bulutun yer değiştirmesinden dolayı grafit elektriği iletir. Malzeme yumuşaktır ve sık sık diğer atomlarla ayrılan tabakalar sadece van der Waals kuvvetleri tarafından tutulur, böylece birbirlerinden kolayca kayabilirler.
Çok yüksek basınçlarda karbon, her bir atomun diğerine dört bağ ile bağlı olduğu, elmas adı verilen bir allotropa sahiptir. Elmas, silikon ve germanyum ile aynı kübik yapıya sahiptir ve karbon-karbon bağlarının gücü sayesinde, çizilmeye karşı dirençli sert bir maddedir. Oda sıcaklığında grafit geçişi farkedilmeyecek kadar yavaştır. Bazı koşullar altında karbon, pırlantaya benzer ancak altıgen bir form olan lonsdaleit olarak kristalleşir.
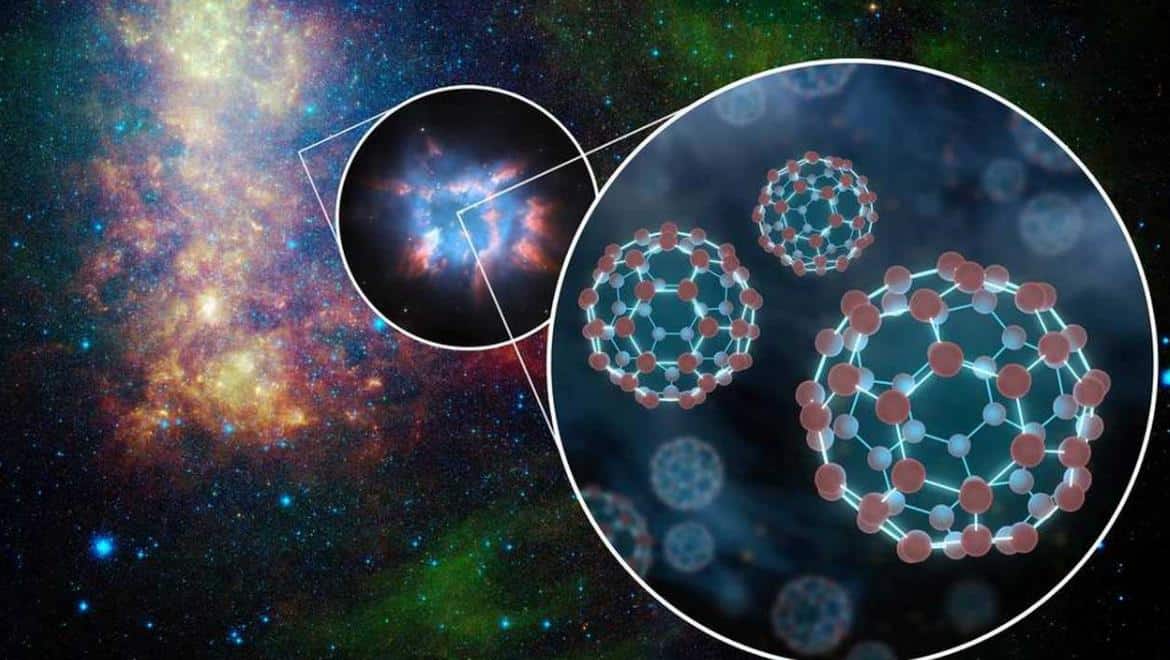
Fullerenler grafit benzeri bir yapıya sahiptir, ancak tamamen altıgen yapı yerine, tabanı küreler, elipsler veya silindirler halinde büken pentagonlardan (veya muhtemelen heptagonlar) oluşur. Fullerenler (“buckyballs” ve “buckytubes” olarak da bilinir) özellikleri henüz tam olarak analiz edilmemiştir.
Karbon Nerelerde Bulunur
Bilinen yaklaşık on milyon karbon bileşiği vardır. Karbon güneşte, yıldızlarda, kuyruklu yıldızlarda ve çoğu gezegenin atmosferinde bol miktarda bulunur. Bazı meteoritler, güneş sistemi hala bir öngezegensel disk iken oluşan mikroskobik elmasları içerir. Diğer elementlerle birlikte, karbon dünyanın atmosferinde de bulunur ve tüm su kütlelerinde çözülür. Daha az miktarda kalsiyum, magnezyum ve demir ile, çok büyük kütleli karbonat kayalarının (kalker, dolomit, mermer vb.) ana bileşenidir. Hidrojen ile birleştiğinde karbon, kömür, petrol ve hidrokarbon denilen doğal gaz oluşturur.
Grafit, Amerika Birleşik Devletleri’nde New York ve Texas’ta büyük miktarlarda bulunur; Rusya; Meksika; Grönland ve Hindistan’da da bol miktarda bulunmaktadır.
Elmas yataklarının çoğu, özellikle Güney Afrika, Namibya, Botsvana, Kongo Cumhuriyeti ve Sierra Leone’de olmak üzere Afrika’dadır. Ayrıca Kanada, Rus Arktik, Brezilya ve Kuzey ve Batı Avustralya’da da bulunmaktadır.
Karbonun absorpsiyon spektrumu
Karbonun emisyon spektrumu
Karbonun Atomik Yapısı
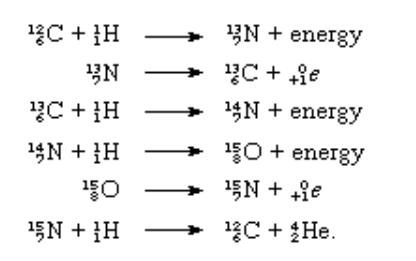
Evren’in %0,5’i karbondan oluşmaktadır. Karbon-12 ve karbon-13 izotopları, bazı yıldızlarda CNO enerji oluşturma döngüsünde yer almaktadır. Bu kimyasal tepkimeler aşağıda gösterilmiştir: