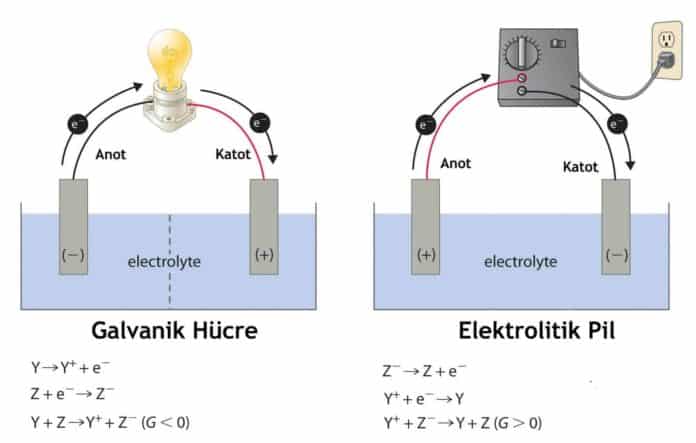
Galvanik hücre, redoks tepkimesi ile elektrik akımı sağlayan bir elektrokimyasal hücre türüdür. Bu hücrede aynı anda yükseltgenme ve indirgenme reaksiyonlarının meydana geldiği bir mekanizma vardır. Bu reaksiyonlar ise genel tabiriyle kimyasal enerjiyi elektrik enerjisine, elektrik enerjisini de kimyasal enerjiye dönüştürmek amacıyla kullanılır. Kimyasal enerjiyi elektrik enerjisine dönüştüren düzeneklere pil, elektrik enerjisini de kimyasal enerjiye dönüştüren düzeneklerde ise elektroliz gerçekleşir. Pil ve elektroliz olaylarının temelini, atomlar arasındaki elektronlar oluşturur. Bir redoks tepkimesinden pil oluşturma fikri ilk kez 1780 yılında Luigi Galvani tarafından ileri sürüldü.

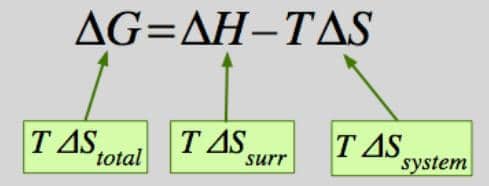
Elektrokimyasal reaksiyonların gerçekleşebilmesi için, Gibbs serbest enerjisinin pozitif bir değerine ve negatif hücre potansiyel farkına sahip olması gerekir.
ΔG°> 0 ise; istemsiz
ΔH°> 0 ise; istemsiz
Galvani pil adı verilen bu redoks pillerinin en basit örneği Daniell Pili denilen Zn/Cu pilidir. Pekala, çalışma sistemi nasıl gerçekleşiyor?
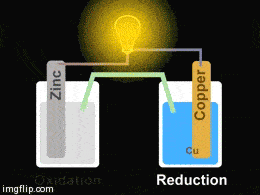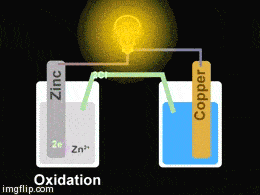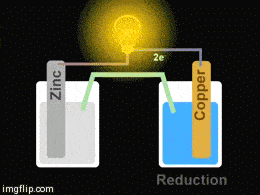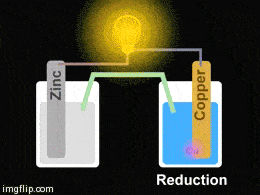
Yukarıdaki giftte Zn/Cu pilinin düzeneği görülmektedir. Pil oluşturmak için iki farklı kapta elektrolit çözeltiler bulunmakta olup bu çözeltilere metal çubuklar daldırılmıştır. Çözeltiler arasına konulan tuz köprüsü ve metal çubuklar arasına konulan iletken bir tel ile devre tamamlanarak bir pil hazırlanmış olur.
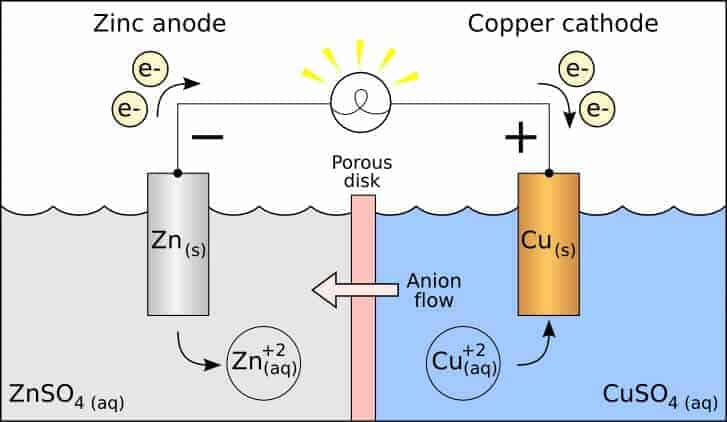
Yükseltgenmenin (oksidasyon) olduğu elektrot anot, indirgenmenin olduğu elektrot ise katot olarak isimlendirilir.
Bu durumda çinko çubuğun yükseltgenme eğilimi bakır çubuktan yüksek olduğu için;
Zn → Zn2+ + 2 e–
Cu2+ +2 e– → Cu(k)
Çinko elektrot zamanla korozyona uğrayacağından kütlesinde bir miktar azalma görülür. Çinko sülfat – hazırlanan- çözeltisi içinde çinko iyonlarının derişimi artar. Elektronlar ise çinko elektrottan bakır elektroda doğru dış devreden akar. Katotta indirgenme olacağı için bakır sülfat çözeltisinde bulunan bakır iyonları indirgenerek bakır elektrodun çevresinde toplanır ve zamanla bakır elektrodun kütlesinde artış gözlemlenir. Tuz köprüsü içinden artı yüklü iyonlar katoda doğru, eksi yüklü iyonlar anoda doğru hareket ederek, elektron nötralliği sağlarlar. Pil tepkimesi bir redoks tepkimesi olduğu için iki yarı tepkimenin toplamına eşittir:
Anot: Zn(k) Zn 2+(aq) + 2 e –
Katot: Cu2+ + 2 e – → Cu(k)
Pil: Zn(k) + Cu2+(aq)
Zn 2+ (aq) + Cu(k)
Pil şeması : ANOT // KATOT
Zn(k) / Zn 2+// Cu2+ / Cu(k) şeklinde ifade edilir.