Yazımızın konusu azot nedir ve azotun özellikleri. Azot (N), periyodik tabloda 15A grubunda olan, atom numarası 7 olan, metalik olmayan bir elementir. Azot, gezegenimizin atmosferinin %78’ini oluşturan tüm canlıların bir bileşeni olan renksiz, kokusuz, tatsız bir gazdır. Dünyanın her yerindeki çiftçiler, gübre olarak azot içeren amonyak (NH3) kullanmaktadır. Azot, amonyak, nitrik asit ve siyanür gibi birçok önemli bileşikler oluşturur.
Azotun Özellikleri Nelerdir
Azot renksiz, −195 ° C de yoğunlaşan, kokusuz bir gazdır. N2 molekülleri olarak mevcuttur: :N:::N: mol başına 226 kilokalorlük bir bağ enerjisine sahiptir. Bu yüksek bağ enerjisinden dolayı, moleküler azotun reaksiyonu için aktivasyon enerjisi genellikle çok yüksektir ve azotun, normal koşullar altında çoğu reaksiyon için nispeten inert olmasına neden olur.
| Azotun Genel Özellikleri | |
|---|---|
| Sembol, Atom Numarası | N, Azot, 7 |
| Grup | ametaller |
| Grup, Periyod, Blok | 15 (VA), 2 , p |
| Yoğunluk, Sertlik | 1.2506 kg/m3(273K), NA |
| Görünüm | renksiz |
| Azotun Atom Özellikleri | |
| Atom ağırlığı | 14.0067 amu |
| Atom yarıçapı | 65 (56) pm |
| Kovalent yarıçapı | 75 pm |
| Van der Waals yarıçapı | 155 pm |
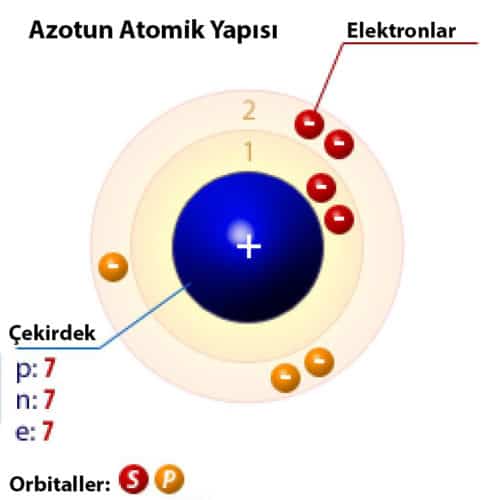
| Elektron konfigürasyonu | [He]2s22p3 |
| e–s başına enerji miktarı | 2, 5 |
| Oksidasyon derecesi | ±3,5,4,2 (güçlü asit) |
| Kristal yapısı | altıgen |
| Azotun Fiziksel Özellikleri | |
| Maddenin hali | gaz |
| Erime noktası | 63.14 K (-345.75 °F) |
| Kaynama noktası | 77.35 K (-320.17 °F) |
| Molar hacim | 13.54 ×10-6 m3/mol |
| Buharlaşma ısısı | 2.7928 kJ/mol |
| Füzyon ısısı | 0.3604 kJ/mol |
| Buhar basıncı | 106.6 [kPa], 77.86 [K] |
| Ses hızı | 334 m/s, 298.15 [K] |
| Azotun Diğer Özellikleri | |
| Elektronegativite | 3.04 ((Pauling ölçeği)) |
| Özgül ısı kapasitesi | 1040 J/(kg*K) |
| Elektriksel iletkenlik | – |
| Termal iletkenlik | 0.02598 W/(m*K) |
| 1. iyonlaşma potansiyeli | 1402.3 kJ/mol |
| 2. iyonlaşma potansiyeli | 2856 kJ/mol |
| 3. iyonlaşma potansiyeli | 4578.1 kJ/mol |
| 4. iyonlaşma potansiyeli | 7475.0 kJ/mol |
| 5. iyonlaşma potansiyeli | 9444.9 kJ/mol |
| 6. iyonlaşma potansiyeli | 53266.6 kJ/mol |
| 7. iyonlaşma potansiyeli | 64360 kJ/mol |
| SI sistemi kullanılmıştır. | |
Azot Ne Zaman Bulundu
Azot (Nitrojen, Latince nitrum) 1772’de yılında İsveçli bir kimyager olan Carl Wilhelm Scheele havayı yanan gaz ve kötü hava veya grizu olarak adlandırmıştı. Buradaki kötü hava azot için, yanan hava ise oksijen için söylenmektedir. Aynı zamanda azot, bir İskoç botanikçi Daniel Rutherford (bulgularını ilk yayınlayan kişi), İngiliz kimyager Henry Cavendish ve bilim adamı Joseph Priestley tarafından da tanındı. Orta Çağ’da ise azot bileşiklerinin çoğu biliniyordu. Simyacılar nitrik asidi, aqua fortis (güçlü su) olarak biliyorlardı. Nitrik ve hidroklorik asitlerin karışımını (kral suyu veya aqua regia), altını çözme tepkimesinde kullanıyorlardı. Tepkime sonunda kloroaurik asit (AuCl4H) meydana gelir.
Azotun Oluşumu ve Dağılımı
Elementler arasında azot kozmik boyutta en çok olan elementler arasında 6. sıradadır. Dünya atmosferi ağırlıkça yüzde 75,51 (veya hacimce yüzde 78,09) azottan oluşur. Atmosfer ayrıca az miktarda amonyak ve amonyum tuzlarının yanı sıra azot oksitleri ve nitrik asidi (elektrik fırtınasında ve içten yanmalı motorda oluşan son madde) içerir. Birçok yerde serbest azot bulunur; volkan, maden ve bazı mineral kaynaklarında, genellikle üre, ürik asit ve bu azotlu ürünlerin bileşikleri formundaki büyük hayvan atıklarında (örneğin, “guano”, 19. yüzyılda tarımda çok popüler olan bir gübredir), Güneşin içinde; ve bazı yıldızlar ve bulutsularda. Azot, tüm canlı organizmalarda bulunan, protein olarak bilinen kompleks organik bileşiklerin ağırlıkça yaklaşık yüzde 16’sını oluşturur.

Azotun Bileşikleri
En çok bilinen ana azot bileşiği NH₃ amonyaktır, hidrazin (N2H4) de bunlardan biridir. Amonyak sudan biraz daha baziktir ve çözelti içinde amonyum iyonları NH4+ oluşturur. Sıvı amonyak aslında biraz amfiprotiktir ve amonyum ve amid iyonları oluşturur (NH2-). Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler. Azot atomlarından oluşan büyük zincir ve halkalı yapılar bilinmektedir, ancak bunlar neredeyse kararsızdır.
Nitrik asit (HNO3), bir başka popüler azot bileşiğidir. Renksiz, aşındırıcı bir sıvıdır; gübrelerin, boyaların, ilaçların ve patlayıcıların üretiminde kullanılır. Üre (CH4N2O) gübrelerde en yaygın azot kaynağıdır. Amonyak ve nitrik asidin bir tuzu olan amonyum nitrat (NH4NO3) ayrıca yapay gübrelerin azotlu bir bileşeni olarak ve bir patlayıcı (ANFO) olarak akaryakıtlara birleştirilerek kullanılır.
Oksijenle azot bileşimi; azotun + 1 oksidasyon durumunda olduğu azot protoksit (N2O) dahil olmak üzere çeşitli oksitler oluşturur; +2 durumunda olduğu azot dioksit (NO2). Azot oksitlerin çoğu aşırı uçucudur; bunlar atmosferdeki başlıca kirlilik kaynaklarıdır. Azot oksit, bazen anestezik olarak kullanılır; solunduğunda hafif histeri gerçekleştirir. Nitrik oksit, kahverengi azot dioksit ve nitrik asit roket yakıtlarında kullanılan güçlü bir oksitleyici maddenin imalatında bir ara ürün oluşturmak üzere oksijen ile hızlı bir şekilde reaksiyona girer.
Nitritler, aynı zamanda genellikle yüksek sıcaklıklarda, metallerin azotla doğrudan bir araya getirilerek sert maddeler oluşturulur. Bunlar alaşımlı çelikler, nitrasyon olarak adlandırılan bir süreçle ısıtılarak yüksek sertliğe sahip alaşımlar üretilmektedir. Bor, titanyum, zirkonyum ve tantal olanlar özel uygulamalara sahiptir. Bir kristalli bor nitrür formu (BN), örneğin, neredeyse elmas kadar serttir ve daha az kolay okside olur ve bu nedenle yüksek sıcaklıkta aşındırıcı olarak kullanışlıdır.
Ayrıca inorganik siyanitler, CN− grubunu içerir. Hidrojen siyanür veya hidrosiyanik asit (HCN), fümigasyonda, cevher konsantrasyonunda ve çeşitli başka endüstriyel işlemlerde kullanılan oldukça uçucu ve aşırı zehirli bir gazdır. Siyanojen veya oksalonitril (CN)2, ayrıca kimyasal bir ara madde ve bir fumigasyon olarak kullanılır.
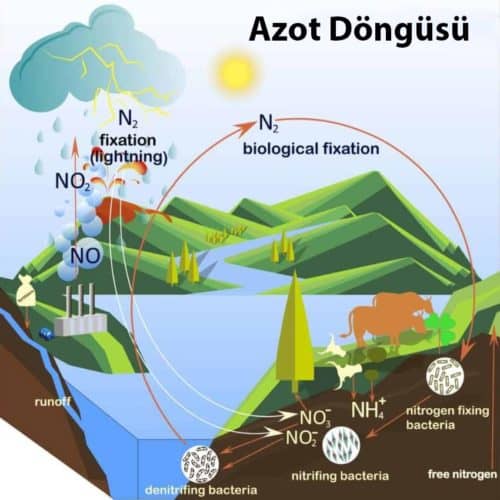
Azot Döngüsü
Azot, Dünya’nın atmosferindeki en bol unsurdur ve tüm canlıların bir bileşenidir. İnsanların ve diğer hayvanların ve bitkilerin hayatta kalması için esastır. Ancak atmosferdeki azotla çevrili olsalar bile, hayvanlar ve bitkiler serbest azot kullanamazlar, çünkü çalışabilecekleri reaktif formlara dönüştürmek için gerekli enzimlerden yoksundurlar. Aslında, tüm daha yüksek yaşam formları, azot fiksasyon işini yapmak için bakterilere dayanır, burada serbest azot, amonyak, nitratlar veya nitritler gibi daha reaktif bileşikler oluşturmak için kimyasal olarak başka elementlerle birleştirilir.
Azot fiksasyonu azot döngüsünün anahtar bir parçasıdır veya azotun doğa yoluyla çeşitli formlarda dolaşımını sağlar. Doğadaki azot fiksasyonunun büyük çoğunluğu, belirli bakteri tipleri ve mavi-yeşil algler tarafından gerçekleştirilir. Azot fiksasyonundan üretilen azot bazlı bileşikler alg ve bitki dokularına alınır. Hayvanlar, algleri ve bitkileri yerler, böylece bileşikleri kendi dokularına alırlar. Hayvanlar hücreleri bileşiklerinde kullanırlar veya bileşikler parçalanır ve üre ve diğer atık ürünler şeklinde atılır. Atık olarak salınan veya ölü organizmaların cisimlerinde oluşan azot bazlı bileşikler amonyağa ve ardından nitratlara ve nitritlere dönüştürülür. Bu bileşikler daha sonra ortamdaki denitrifiye edici bakteriler tarafından tekrar atmosferik nitrojene dönüştürülür.
Azotun İzotopları
İki kararlı izotop vardır: N-14 ve N-15. Şimdiye kadar en yaygın olanı yıldızlarda CNO döngüsünde üretilen N-14’tür (% 99.634). Gerisi N-15. Sentetik olarak üretilen on izotoptan birinin yarısı dokuz dakikalık bir ömre sahiptir ve kalan izotopları saniye veya daha az bir sırada yarı ömre sahiptir. Biyolojik aracılı reaksiyonlar (örneğin asimilasyon, nitrifikasyon ve denitrifikasyon), topraktaki azot dinamiklerini güçlü bir şekilde kontrol eder. Bu reaksiyonlar hemen hemen her zaman N-15 substratının zenginleşmesine ve ürünün tükenmesine neden olur.
Azotun Atomik Yapısı
Azotun biyolojik rolü; azot, tüm yaşam için hayati öneme sahip amino ve nükleik asitlerin önemli bir parçasıdır.