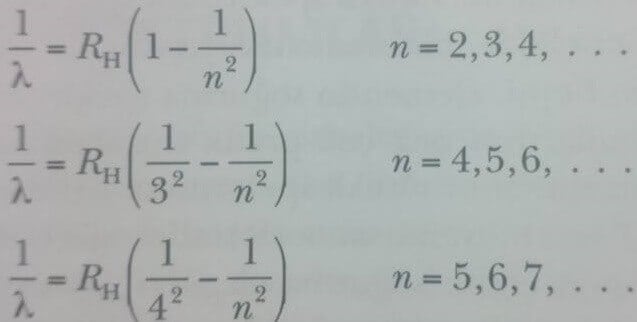Merhaba arkadaşlar bugün sizlere atom spektrumları ve bazı atom spektrumları ile ilgili örnekler ve şekiller vererek, konuyu daha basit anlamanıza yardımcı olacağım. Bütün cisimler, sürekli bir dalga boyu dağılımı ile karakterize edilen ısıl ışıma yayınlarlar. Bu sürekli dağılım spektrum ile taban tabana zıt olarak, elektrik boşalmasına uğrayan düşük basınçtaki gazlar kesikli çizgi spektrumu yayınlarlar. (Gazlar, dielektrik şiddetlerinden daha büyük bir elektrik alanı yaratacak potansiyel farkı etkisi altında kaldıklarında elektrik boşalması oluşur.) Bu yayınlanan ışığın gözlem ve analizine yayınlama (emisyon/yayma) spektroskopisi adı verilir.
Bazı Atom Spektrumları
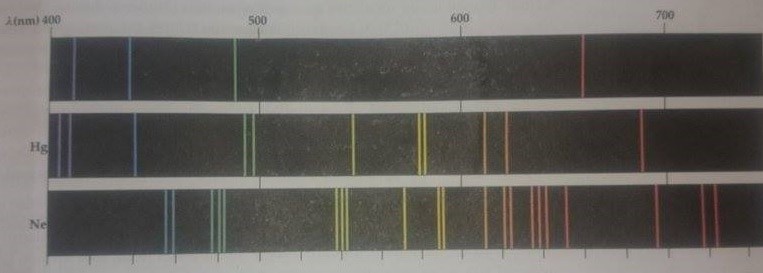
Bir gaz boşalmasından gelen ışık spektraskop ile incelendiğinde genellikle karanlık arka fon üzerinde birkaç parlak renkli çizgi görünür. (Çizgiler ışığın bir yarıktan geçmesi sonucu oluşurlar.) Bu kesikli çizgi spektrumu, parlayan sıcak bir katıdan gelen ışığa spektrometreden bakıldığında görülen sürekli gök kuşağı renkleri ile keskin bir tezat durumdadır. Ayrıca Şekil 1a (Hidrojen, cıva ve neonun emisyon çizgi spektrumları) da görebileceğimiz gibi, belirli bir çizgi spektrumunun içerdiği dalga boyları, ışık yayınlayan elementin karakteristiğidir. En basit çizgi spektrumu hidrojen atomununkidir ve biz bu spektrumu ayrıntılı olarak inceleyeceğiz. Diğer atomlar bütünüyle farklı çizgi spektrumlarına sahiptirler. İki farklı element ayrı çizgi spektrumuna sahip olmadıkları için, bu görüngü (fenomen) bilinmeyen örnekler içinde bulunan elementlerin tanınması için pratik ve hassas bir teknik sunar.

Maddelerin analizinde çok kullanışlı olan diğer bir spektraskopi şekli yutma (soğurma/absorpsiyon) spektroskopisidir. Soğurma spektrumu, sürekli bir kaynaktan elde edilen ışığın analiz edilen gaz veya seyreltik çözeltiden geçirilmesi ile elde edilir. Soğurma spektrumu, Şekil 1b (Hidrojenin soğurma spektrumu) deki hidrojen atomununki gibi, ışık kaynağının sürekli spektrumu üzerindeki karanlık çizgiler irisinden oluşur. Genellikle, bir elementin yayınlama (yayma) spektrumunda bulunan çizgilerin hepsi, elementlerin soğurma spektrumunda olmayabilir.
Soğurma spektrumları pek çok pratik uygulamaları vardır. Örneğin, Güneşten yayımlanan ışımanın sürekli spektrumu, daha soğuk gazlardan oluşan Güneş atmosferi ve Dünyanın atmosferinden geçerek bize gelir. Güneş spektrumunda gözlenen çeşidi soğurma çizgileri Güneş atmosferindeki elementleri belirlemek için kullanılmıştır. Güneş spektrumunun ilk incelemelerinde bilinen hiçbir elemente karşı gelmeyen bazı çizgiler bulundu. Yeni bir element keşfedilmişti! Yeni elemente Yunancada Güneş anlamına gelen helios kelimesinden türetilen helyum adı verildi. Helyum sonradan Dünyada yeraltı gazları içinden ayrıştırıldı.
Bilim adamları bu yöntemle Güneşin dışındaki diğer yıldızlardan gelen ışıkları da inceleyebildiler, ancak şimdiye kadar dünya üzerinde olmayan yeni bir elemente rastlanmadı. Soğurma spektrumu, gıda zincirindeki ağır metal kirliliğinin analizinde de kullanışlı bir yöntem olmuştur. Örneğin, ton balığında yüksek seviyede cıva varlığının tespiti ilk defa atomik soğurma spektroskopisi kullanılarak yapılmıştır.
Neon lambalarında gaz boşalmalarından kaynaklanan ışığın kesikli emisyonları kullanılır. Bu tip lambalarda ilk kullanılan ve onlara ismini veren neon gazı kırmızı bölgede şiddetli ışıma yapar. Sonuç olarak neon gazı dolu bir cam tüp sürekli boşalmaya neden olacak bir potansiyel farkı altında tutulduğunda parlak kırmızı ışık yayınlar. İlk neon lambalarında, genel olarak bu lambaların parlaklığı çok düşük olmasına rağmen, farklı renkler elde etmek için farklı gazlar kullanılıyordu. Günümüzde kullanılan “neon” lambalarının çoğu, elektromanyetik spektrumun morötesi bölgesinde şiddetli ışıma yapan cıva buharı ile doludur. Cam tüpün içini, cıvadan gelen morötesi ışımayı soğurduğunda belirli bir renkte ışık yayan bir fosfor maddesi ile kaplanmıştır. Tüpün vereceği ışığın rengi seçilen belirli fosfora bağlıdır. Cam tüpün içi beyaz ışık veren fosfor ile kaplandığında aynı ilke ile çalışan fleoresan lamba elde edilir.

1860’tan 1885’e kadar bilim adamları spektroskopik ölçümleri kullanarak çok miktarda atomik emisyon verileri toplamışlardı. 1885 de, İsviçreli bir öğretmen olan Johann Jacob Balmer (1885-1898) hidrojenin dört görülebilir emisyon çizgisinin (Hα(kırmızı), Hβ(yeşil), Hγ(mavi), ve Hδ(mor)) dalga boylarını doğru olarak öngören bir ampirik bağıntı buldu. Şekil 2 de hidrojenin yayma (emisyon) spektrumundaki bu ve (morötesi bölgesindeki) diğer çizgiler gösterilmiştir. Bu çizgiler takımına Balmer serisi adı verilir. Dört görünür çizgi 656,3 nm, 486,1 nm, 434,1 nm ve 410,2 nm dalga boylarında ortaya çıkarlar. Bu çizgelerin dalga boyları, Balmer’in orijinal eşitliğinin Johannes Rydberg (1854-1919) tarafından düzeltilmiş şekli olan aşağıdaki eşitlik ile hesaplanabilirler:
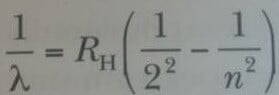
burada n 3,4,5… değerleri alabilen bir tamsayı ve RH ise şimdi Rydberg sabiti olarak isimlendirilen bir sabittir. Dalga boyları metre olarak ölçülürse RH nın değeri 1.0973732 х 107 m-1 olur. Balmer serisindeki 656,3 nm dalga boylu çizgi Eşitlik 1 de n = 3’e; 486,1 nm deki çizgi n = 4 ve benzeri değerlere karşılık gelirler. Ölçülen spektrum çizgileri bu ampirik bağıntı ile %0,1 duyarlılıkla uymludurlar.
Balmer’in keşfinden sonra hidrojen spektrumunun diğer çizgileride bulundu. Bu spektrumlar onları keşfedenlerin isimleri ile Lyman, Paschen ve Brackelt serisi olarak adlandırılır. Bu serilerdeki çizgilerin dalga boylan aşağıdaki ampirik formüller kullanılarak hesaplanabilirler:
Bu eşitliklerin hepsi bütünüyle ampiriktir; yani onlara ait hiçbir teorik temel yoktur, fakat basitçe çok güzel sonuçlar verirler.