Merhaba arkadaşlar sizlere bugün atom modelleri ve atom modelleri tarihsel gelişimini anlatacağım. Newton zamanındaki atom modelleri küçük, sert ve dayanıklı bir küre şeklindeydi. Bu model, gazların kinetik teorisi için iyi bir temel oluşturdu.
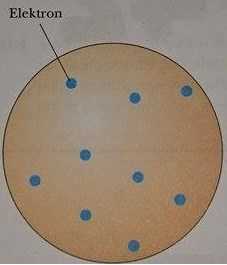
Daha sonraları atomların elektriksel özelliklerini açığa çıkaran deneyler yapıldığında yeni modellerin tasarlanması gereği ortaya çıktı, J. J. Thomson, karpuz çekirdeklerinin bir karpuz içinde yerleşmesine ya da kuru üzümlerin üzümlü kek içine yerleşmesine benzer şekilde elektronların da pozitif bir hacim içine düzgün dağılımlı olarak yerleştiği bir atom modeli önerdi (Şekil 1).
Atom Modelleri’ninTarihsel Gelişimi
1911 de, Ernest Rutherford (1871-1937) ile öğrencileri Hans Geigerve ve Ernst Marsden, Thomson atom modelinin doğru olamayacağını gösteren kritik bir deney düzenlediler. Bu deneyde, şimdi helyum atomlarının çekirdeği olarak bilinen pozitif yüklü alfa parçacıkları demeti, Şekil 2a daki gibi ince bir metal yaprak üzerine gönderildi. Deneyin sonuçlan çok şaşırtıcıydı. Alfa parçacıklarının çoğu, sanki boş uzayda gidiyormuş gibi metal yapraktan geçiyordu. İlk izledikleri yoldan sapan alfa parçacıklarının bir çoğu da çok büyük açılar ile saçılmaktaydı. Bazı alfa parçacıkları ise başlangıç doğrultularının tam tersi yönünde geriye doğru saçılmaktaydı. Bazı alfa parçacıkları ise başlangıç doğrultulanımı tam tersi yönünde geriye doğru saçılmaktaydı! Geiger, bazı alfa parçacıklarının geriye doğru saçıldığını vurgulayarak Rutherford’a bilgi verdi. Bu olayla ilgili olarak Rutherford şöyle yazdı: “Bu olay şu ana kadar hayatımda karşılaştığım en inanılmaz olaydır. Öyle ki bu olay 15 inç kalınlığında bir parça kağıt dokuya tabancayla ateş etmenizden sonra, merminin kağıt dokudan geri gelerek sizi vurmasına benzeyen inanılmaz bir olaydır”.
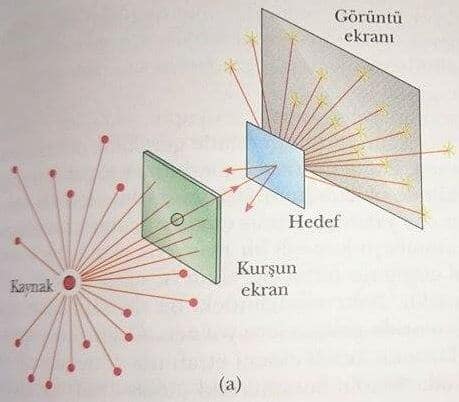
Thomson’un modeli temel alındığında, Rutherford deneyinde görülen büyük sapmaların olmaması gerekiyordu. Çünkü, pozitif yüklü bir alfa parçacığının, üzümlü kek modelindeki yük hacmine büyük açılı sapmalar yapacak kadar yaklaşması mümkün değildir. Rutherford, gözlemlerini pozitif yükün atomun boyutuna göre küçük olan bir bölgede yoğunlaştığını varsayarak açıkladı. Rutherford pozitif yüklü bu yoğun bölgeye atomun çekirdeği adını verdi. Atoma ait olan elektronların çekirdeğin dışında oldukça büyük bir hacim kapladığı varsayıldı. Rutherford atomun bu dış bölgesindeki elektronların çekirdeğin içerisine çekilmemesinin nedenini açıklamak için güneş sistemine benzeyen bir model geliştirdi. Bu modele göre, gezegenlerin güneşin etrafında dolanmasına benzer biçimde elektronlar da, Şekil 2b de olduğu gibi, pozitif yüklü çekirdeğin etrafındaki yörüngelerde hareket etmelidir.
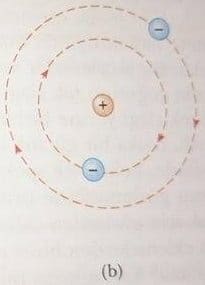
Rutherford un gezegen modelinde iki temel güçlük vardır. Bir atom elektromanyetik spektrum içinde yalnızca kendine özgü belirli frekansları yaymakla ve bunların dışında elektromanyetik ışıma yaymamaktadır. Rutherford modeli bu olayı açıklamada yetersiz kalır. İkinci güçlük de, ivmeli bir yükün klasik teoriye göre elektromanyetik dalga formunda enerji yayma zorunluluğundan ortaya çıkmaktadır. Rutherford modelinde elektronlar çekirdek etrafındaki dairesel yollarda hareket ettiklerinde, merkezcil bir ivmenin etkisindedirler. Elektromanyetizmanın Maxwell teorisine göre merkezcil ivmenin etkisi altında f frekansıyla dairesel yörüngede dönen yükler, Hertz’in 1888 de doğruladığı gibi f frekanslı elektromanyetik dalgalar yaymalıdır. Ne yazıktır ki, bu klasik model de bir talihsizliğe uğrar. Bu modele göre elektron çekirdek etrafında dolanırken enerji yayar, enerji yaydıkça yörüngesinin yarıçapı sürekli olarak küçülür buna karşın dolanım frekansı büyür. Bu da yayılan ışınım frekansının sürekli artışına karşılık gelir. Sonunda elektron çekirdek içine düşer ve atomun çökmesine neden olur (Şekil 3).
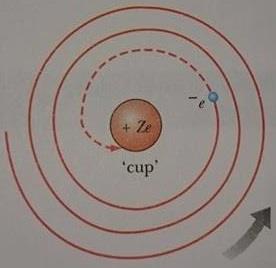
Artık Bohr için sahne hazırdı! Çekirdek etrafında dolanan elektronların çekirdek içine düşmesi ve elementlerin sürekli ışıma spektrumu vermesi biçimindeki gerçeğe uymayan aldatıcı sonuçları ortadan kaldırmak amacıyla Bohr, klasik ışıma teorisinin atomik boyutlu sistemler için geçerli olmadığını ileri sürdü. Bohr, sürekli olarak enerji kaybeden klasik elektron probleminden kurtulmak için Planck’ın kuantumlu enerji düzeyleri düşüncesini yönünde dolanan elektronlara uyguladı. Dolayısıyla atomlardaki elektronların kararlı, durumlar denen ve elektronların oradayken ışıma yapmadığı, kararlı enerji düzeylerinde ve yörüngelerde bulunduğunu öngördü. Bohr, daha ileri giderek elektronların bir kararlı durumdan başka bir kararlı duruma geçmesi halinde yayınlanan ışığın frekansını ifade etmek için de Einstein’ın foton kavramını kullandı.
Hidrojenin spektral çizgileri gelişmiş spektroskopik tekniklerle incelenmeye başlandığında Bohr teorisinin düzeltilmesinde gereklilik olduğu ortaya çıktı. Bu incelemeler sırasında, Balmer serisi çizgilerinin ve diğer seri çizgilerinin çoğunun tek çizgi şeklinde olmadığının farkına varıldı. Aslında her çizgi tek çizgi yerine birbirine çok yakın yerleşmiş çizgiler grubundan oluşmaktaydı. Başka bir güçlük de atomların kuvvetli bir manyetik alan içine konması halinde, belirli tek spektral çizgilerin birbirine yakın üç çizgi halinde ayrıldığının gözlemesinde ortaya çıktı. Bohr modelindeki bu tür sapmaları açıklamak için gösterilen çabalar teoride gelişmelere yol açtı. Orijinal teoriye yapılan eklemelerden birisi elektronun kendi ekseni etrafında dönebileceği (spin yapması) kavramıydı. Bu arada Arnold Sommerfeld (1868-1951) de elektron hareketinin analizine rölativite teorisini katarak Bohr teorisini biraz daha ileri götürdü.Bugünkü yazımızda size atom modelleri ve atom modelleri tarihsel gelişimini anlattım.Diğer yazımızda görüşmek üzere.